1,3-Pentadien
1,3-Pentadien ist eine unpräzise Bezeichnung für zwei chemische Verbindungen aus der Gruppe der Diene, die zueinander isomer (Konfigurationsisomere) sind. Sie werden meist cis- bzw. trans-1,3-Pentadien genannt. Das Isomerengemisch wird auch als Piperylen (abgeleitet von Piperin[4][5]) bezeichnet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
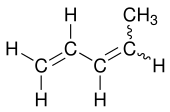
| ||||||||||||||||
| Strukturformel ohne Angabe zur (EZ)-Konfiguration | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,3-Pentadien | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H8 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 68,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,68 g·cm−3[1] | |||||||||||||||
| Siedepunkt |
42 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Ein Konstitutionsisomer der 1,3-Pentadiene ist der verzweigte Kohlenwasserstoff 2-Methylbutadien (Isopren).
Geschichte
BearbeitenAugust Wilhelm Hofmann ließ 1-Methylpiperidin mit Methyliodid zum quartären Ammoniumiodid reagieren und führte die später nach ihm benannte Abbau-Reaktion durch, die Hofmann-Eliminierung. Das gebildete N,N-Dimethylpent-4-enylamin wurde nochmals diesem Abbau unterworfen. Der nach zweimaliger Eliminierung entstehende ungesättigte Kohlenwasserstoff wurde von Hofmann vorläufig als Piperylen bezeichnet; der Name blieb aber noch lange in Gebrauch.[4] Bei der Eliminierung von Trimethylamin aus dem N,N-Dimethylpent-4-enylamin entsteht zunächst 1,4-Pentadien, das aber unter den Reaktionsbedingungen zum 1,3-Pentadien isomeriert.[6]
Vorkommen
Bearbeiten1,3-Pentadien kommt natürlich im Öl der Pelargonium graveolens vor.[7]
Isomere
Bearbeiten| Isomere von 1,3-Pentadien | |||||||
| Name | trans-1,3-Pentadien | cis-1,3-Pentadien | |||||
| Andere Namen | trans-Penta-1,3-dien (E)-1,3-Pentadien trans-Piperylen (E)-Piperylen |
cis-Penta-1,3-dien (Z)-1,3-Pentadien cis-Piperylen (Z)-Piperylen | |||||
| Strukturformel | |||||||
| CAS-Nummer | 2004-70-8 | 1574-41-0 | |||||
| 504-60-9 (Isomerengemisch) | |||||||
| EG-Nummer | 217-909-5 | 216-401-0 | |||||
| 207-995-2 (unspez.) | |||||||
| ECHA-Infocard | 100.016.282 | 100.014.911 | |||||
| 100.007.269 (unspez.) | |||||||
| PubChem | 62204 | 643785 | |||||
| – (unspez.) | |||||||
| Wikidata | Q126292 | Q27286734 | |||||
| Q72499706 (unspez.) | |||||||
| Schmelzpunkt | −87 °C[8] | −141 °C[9] | |||||
| Siedepunkt | 42 °C[8] | 44 °C[9] | |||||
| Dichte | 0,683 g·cm−3 (25 °C)[8] | 0,691 g·cm−3 (25 °C)[9] | |||||
| Dampfdruck | 452 hPa (20 °C)[8] | 453 hPa (20 °C)[9] | |||||
| Standardbildungsenthalpie | = +18,11 ± 0,16 kcal/mol[10] | = +19,77 ± 0,22 kcal/mol[10] | |||||
| Brechungsindex | 1,430 (20 °C)[8] | 1,437 (20 °C)[9] | |||||
| GHS- Kennzeichnung |
|
| |||||
| H- und P-Sätze | 225‐304‐315‐319‐335 | 225‐304 | |||||
| keine EUH-Sätze | keine EUH-Sätze | ||||||
| 210‐261‐301+310‐305+351+338‐331 | 210‐301+310‐331 | ||||||
Gewinnung und Darstellung
Bearbeiten1,3-Pentadien kann durch eine Wittig-Reaktion aus Acetaldehyd, Acrolein oder Crotonaldehyd hergestellt werden, wobei sowohl die Ausbeute als auch die cis/trans-Selektivität in Abhängigkeit von verschiedenen Faktoren (z. B. dem Ausgangsstoff oder dem verwendeten Lösungsmittel) variiert.[11]
Industriell entsteht es als Nebenprodukt des Trennprozesses von rohen C5-Materialien von Pyrolysebenzin (Pygas) – beide Nebenprodukte der Herstellung von Ethylen.[12]
Die Herstellung kann auch durch Methylierung von 1,3-Butadien mit Dimethylsulfoxid in Gegenwart einer Base wie Kalium-tert-butoxid erfolgen, wobei ein Gemisch aus etwa 80 % trans- und 20 % cis-1,3-Pentadien entsteht.[2] Chemiker der Esso Research and Engineering Company in Linden, New Jersey (USA) berichteten über die Methylierung von 1,3-Butadien und anderen ungesättigten Kohlenwasserstoffen mittels Dimethylsulfoxid. Letzteres wird durch starke Basen deprotoniert, wobei das Dimsylat-Anion entsteht. Dieses wird an das konjugierte Dien addiert.[13][14]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
Bearbeiten1,3-Pentadien ist eine farblose Flüssigkeit mit Siedepunkt 42–44 °C.[8] Untersuchungen zur Thermodynamik von Pentadienen in der Gasphase ergaben, dass die molaren Bildungsenthalpien von cis- und trans-1,3-Pentadien sich um 6,95 kJ/mol unterscheiden. Danach ist das trans-Isomer etwas stabiler.[10]
Chemische Eigenschaften
BearbeitenBeim Erhitzen von cis-1,3-Pentadien auf ca. 250 °C kann ein Wasserstoffatom der Methylgruppe mit der terminalen Methylidengruppe verknüpft werden. Es handelt sich um ein chemisches Gleichgewicht, das thermische 1,5-Wasserstoffverschiebung, kurz 1,5-H-Verschiebung (engl. 1,5-H-Shift) genannt wird.[15] In diesem Fall ließ es sich nur durch Markierung des Pentadiens mit Deuteriumisotopen nachweisen.[16] Die Reaktion wurde von Robert Burns Woodward und Roald Hoffmann als 1,5-sigmatrope Verschiebung klassifiziert, welche konzertiert und suprafacial erfolgt.[17] Verschiedene quantenchemische Berechnungen haben sich mit dieser Reaktion befasst.[18][19] (Anmerkung: Die o. g. Isomerisierung von 1,4-Pentadien zu 1,3-Pentadien wäre als suprafaciale 1,3-H-Umlagerung konzertiert nicht möglich; offenbar ist diese Reaktion basenkatalysiert).
1,3-Pentadien reagiert mit molekularem Brom zu diastereomeren 1,2,3,4-Tetrabrompentanen. Diese Tetrabromide spielten schon bei A. W. Hofmanns Konstitutionsbestimmung (s. o.) eine Rolle, um nachzuweisen, dass die Verbindung zwei C=C-Doppelbindungen enthält.
Die wichtigste Reaktion des 1,3-Pentadiens dürfte die Polymerisation zu Polypentadienen sein. Wie beim Polybutadien können die Verknüpfungen des Monomers in 1,2- und 1,4-Position („1,2-Addition“ bzw. „1,4-Addition“) stattfinden. Mit Butyllithium initiiert ist eine anionische Kettenpolymerisation möglich.[20]
In Anlehnung an die im Ziegler-Natta-Verfahren verwendeten Katalysatoren wurden mit Cobalt-haltigen Organoaluminium-Verbindungen, die z. B. aus Diethylaluminiumchlorid (AlEt2Cl), oder Triethyl-dialuminiumtrichlorid (Al2Et3Cl3) hergestellt wurden, Katalysatoren entwickelt, mit denen Polymere verschiedener Struktur und Eigenschaften erhalten werden. Kristalline Polymere bestehen aus cis-1,4-syndiotaktischen Strukturelementen, amorphe Polymere sind aus cis-1,4- und 1,2-Einheiten zusammengesetzt. Schwach kristalline Polymere haben eine 1,2-syndiotaktische Struktur.[21] Mit einem ähnlichen Cobalt-Katalysator wurde trans-1,2-Poly-1,3-pentadien hergestellt.[22]
Verwendung
Bearbeiten1,3-Pentadien, b. z. w. Piperylen dient in erster Linie als Monomer bei der Herstellung von Kunststoffen, Klebstoffen und Harzen. Piperylen-basierte Produkte werden insbesondere in modernen Klebstoffen – wie bei der Herstellung von Briefumschlägen, Paketband und Windelbefestigungen – sowie weltweit in Fahrbahnmarkierungen verwendet. Außerdem wird 1,3-Pentadien zur Herstellung anderer chemischer Verbindungen wie z. B. 2-Methylfuran verwendet.[12]
Literatur
Bearbeiten- Arno Behr, Peter Neubert: Piperylene — A Versatile Basic Chemical in Catalysis. In: ChemCatChem, 6, 2013, S. 1867–3880. doi:10.1002/cctc.201300523.
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Eintrag zu P1841 1,3-Pentadiene (cis- and trans- mixture) (stabilized with TBC), >96.0% bei TCI Europe, abgerufen am 7. November 2022.
- ↑ a b Eintrag zu trans-1,3-Pentadiene in der Hazardous Substances Data Bank (via PubChem), abgerufen am 13. Oktober 2012.
- ↑ Registrierungsdossier zu Penta-1,3-diene (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 25. April 2022.
- ↑ a b A. W. Hofmann: Einwirkung der Wärme auf die Ammoniumbasen. In: Berichte der deutschen chemischen Gesellschaft. 14, 1881, S. 659–669. doi:10.1002/cber.188101401148.
- ↑ C. Schotten: Beitrag zur Kenntniss des Piperidins. In: Berichte der deutschen chemischen Gesellschaft 15, 1882, S. 421–427, doi:10.1002/cber.18820150186.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. John Wiley & Sons, 2003, ISBN 3-906390-29-2, S. 255 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ 1,3-PENTADIENE (engl.) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 8. Juli 2024.
- ↑ a b c d e f g Datenblatt trans-1,3-Pentadiene, 90% bei Sigma-Aldrich, abgerufen am 13. Oktober 2012 (PDF).
- ↑ a b c d e f Datenblatt cis-1,3-Pentadiene, 98% bei Sigma-Aldrich, abgerufen am 13. Oktober 2012 (PDF).
- ↑ a b c Frances Maron, J. Prosen: Heats of Combustion and Isomerization of Six Pentadienes and Spiropentane. In: Journal of Research of the National Bureau of Standards. 54, 1955, Research Paper No. 2575.
- ↑ Jerome Thomas Kresse: The investigation of factors influencing the stereochemistry of the Wittig reaction (PDF; 3,9 MB), University of Florida, Diss., 1965.
- ↑ a b Shell Chemicals: Piperylene product overview ( vom 18. September 2013 im Internet Archive).
- ↑ P. A. Argabright, J. E. Hofmann, A. Schriesheim: Methylation of Simple Unsaturated Hydrocarbons by Dimethyl Sulfoxide. In: The Journal of Organic Chemistry. 30, 1965, S. 3233–3235. doi:10.1021/jo01020a525.
- ↑ Herman Pines: Base-Catalyzed Carbon-Carbon Addition of Hydrocarbons and of Related Compounds. In: Accounts of Chemical Research. 7, 1974, S. 155–162. doi:10.1021/ar50077a005.
- ↑ Übersicht: V. A. Mironov, A. D. Fedorovich, A. A. Akhrem: The 1,5-Shift Reaction. In: Russian Chemical Reviews. 50, 1981, S. 666–677. Russisches Original: Uspekhi Khimii. 50, 1981, S. 1272–1303.
- ↑ W. R. Roth, J. König: Kinetischer Isotopeneffekt der 1.5-Wasserstoffverschiebung im cis-Pentadien-(1.3). In: Justus Liebigs Annalen der Chemie. 699, 1966, S. 24. doi:10.1002/jlac.19666990103.
- ↑ R. B. Woodward, R. Hoffmann: Die Erhaltung der Orbitalsymmetrie, S. 114 und 123. Verlag Chemie, Weinheim, 1970.
- ↑ B. A. Heß, L. J. Schaad: Ab initio study of the transition structure of the [1,5]-sigmatropic hydrogen transfer in cis-1,3-pentadiene. In: Journal of the American Chemical Society 105, 1983, S. 7185–7186. doi:10.1021/ja00362a035.
- ↑ Kendall N. Houk, Yi Li, Jeffrey D. Evanseck: Übergangsstrukturen in pericyclischen Reaktionen von Kohlenwasserstoffen. In: Angewandte Chemie, 104, 1992, S. 711–739. doi:10.1002/ange.19921040606.
- ↑ US-Patent 4486614-A für Dow Chemicals Co. vom 4. 12. 1984, Erfinder Felipe A. Donate, John W. Bozzelli, Kent S. Dennis.
- ↑ L. Porri, A. di Corato, G. Natta: Polymerization of 1,3-pentadiene by cobalt catalysts. Synthesis of 1,2 and cis-1,4 syndiotactic polypentadienes. In: European Polymer Journal. 5, 1969, S. 1–13. doi:10.1016/0014-3057(69)90097-4.
- ↑ US-Patent 3824226-A vom 16.07.1974 für Bayer AG: Process for the production of trans-1,2-poly-1,3-pentadiene, Erfinder G. Marwede, G. Pampus, F. Haas, P. Gunther, W. Oberkirch, Priorität vom 28.03.1970. A Catalyst system for the stereospecific polymerisation of 1,3-pentadiene into trans-1,2-poly-1,3-pentadiene, comprisimg (A) an anhydrous cobalt salt (B) an acid amide or an ether and (C) an organoaluminium compound and a process for polymerising 1,3-pentadiene in an inert solvent at temperatures of from -50° to +100 °C. Using the catalyst.


