Thionylchlorid (Trivialname) ist eine stark lichtbrechende farblose Flüssigkeit, das Dichlorid der Schwefligen Säure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
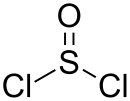
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thionylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | SOCl2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, stark lichtbrechende, erstickend riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 118,97 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
76 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,518 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 1 ml·m−3 bzw. 5 mg·m−3[5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Geschichte
BearbeitenThionylchlorid wurde erstmals im Jahre 1849 durch die Umsetzung von Schwefeldioxid mit Phosphorpentachlorid erhalten.[6][7] Nachdem seine Eignung als Chlorierungsreagenz erkannt wurde, wurde es etwa ab 1900 im industriellen Maßstab hergestellt und verwendet.[8]
Eigenschaften
BearbeitenThionylchlorid ist eine farblose bis gelbliche, an der Luft rauchende Flüssigkeit, die sich in Wasser oder bei Erhitzung oder unter Lichteinwirkung zersetzt. Ihre Dämpfe wirken schon bei großer Verdünnung erstickend.[2] Die Verbindung reagiert heftig mit Wasser und Basen sowie mit einigen Alkoholen. Beim Erhitzen über 80 °C zerfällt es in Schwefeldioxid, Chlor und Dischwefeldichlorid,[9] gemäß der Gleichung:
Bei der Reaktion mit Wasser bilden sich Chlorwasserstoff und Schwefeldioxid:[2]
Herstellung
BearbeitenThionylchlorid wird im Labor durch Einleiten von Schwefeltrioxid in Schwefeldichlorid oder durch Überleiten von Schwefeldioxid über Phosphorpentachlorid hergestellt:[10]
Verwendung
Bearbeiten- In Lithium-Thionylchlorid-Batterien als Lösungsmittel und Elektrolyt
- Industriell wird Thionylchlorid zur Herstellung folgender Substanzen verwendet:
Einzelnachweise
Bearbeiten- ↑ a b Eintrag zu Thionylchlorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Mai 2014.
- ↑ a b c d e f g h i j k l Eintrag zu Thionylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ Datenblatt Thionyl chloride bei Sigma-Aldrich, abgerufen am 3. Oktober 2016 (PDF).
- ↑ Eintrag zu Thionyl dichloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7719-09-7 bzw. Thionylchlorid), abgerufen am 2. November 2015.
- ↑ M. Persoz: In: Compt. Rend. 28, 1849, S. 86–88.
- ↑ P. Kremers: In: Justus Liebigs Ann. Chem. 70, 1848, S. 297–300.
- ↑ H.-D. Lauss, W. Steffens: Sulfur Halides. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag, Weinheim 2012, doi:10.1002/14356007.a25_623.
- ↑ Thionylchlorid (7719-09-7), Universität Münster, abgerufen am 4. November 2014.
- ↑ G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. vol. 1, Academic Press, 1963, S. 382–383.

