Cinchonidin gehört zur Gruppe der China-Alkaloide. Es ist – wie die meisten Alkaloide – physiologisch aktiv und ist ein Pflanzengift.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
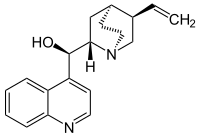
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cinchonidin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C19H22N2O | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 294,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (0,25 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vorkommen
Bearbeiten(–)-Cinchonidin und das Isomer (+)-Cinchonin kommen in der Natur in der Rinde von Chinarindenbäumen (hauptsächlich Cinchona spp, Cinchona pubescens und Cinchona ledgeriana)[5][6] vor und können daraus extrahiert werden.
Chemische Eigenschaften und Verwendung
BearbeitenCinchonidin kristallisiert als farblose Nadeln und Prismen im orthorhombischen Kristallsystem. Es ist geruchlos und schmeckt bitter, wobei es in alkoholischer Lösung noch bitterer wird.[7] Bei der Destillation von Cinchonin mit Kaliumhydroxid wird Chinolin gebildet.[8]
(–)-Cinchonidin wird zur Spaltung von Racematen verwendet. Es bildet mit racemischen Säuren diastereomere Salze, die durch fraktionierte Kristallisation aufgetrennt werden können.[9] (–)-Cinchonidin gehört zu den Cinchona-Alkaloid-Katalysatoren, die als chirale Amine Lewis-Basen sind. Diese katalytischen Reaktionen sind in der org. Chemie vielfältig verwendbar. Ein Beispiel hierfür ist die 1,4-Additions-Reaktion nach Wynberg.[10]
Sicherheitshinweise
BearbeitenIm Tierversuch mit Ratten wurde für (–)-Cinchonidin bei intraperitonealer Gabe ein LD50-Wert von 206 mg/kg ermittelt. Die Tiere waren auch bei subletalen Dosen vermindert aktiv bis schläfrig und zeigten Muskelzittern und Krämpfe.[3]
Einzelnachweise
Bearbeiten- ↑ a b c d Datenblatt Cinchonidin (PDF) bei Carl Roth, abgerufen am 9. Mai 2017.
- ↑ Datenblatt (–)-Cinchonidin bei Merck, abgerufen am 23. März 2011.
- ↑ a b Cecil C. Johnson, Charles F. Poe: Toxicity of Some Cinchona Alkaloids. In: Acta Pharmacologica et Toxicologica. Band 4, Nr. 3-4, 2009, S. 265–274, doi:10.1111/j.1600-0773.1948.tb03348.x.
- ↑ Daunderer: Klinische Toxikologie, Cinchonidin ffl-443; 69. Erg.-Lfg. 8.91.
- ↑ CINCHONIDINE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. Juli 2021.
- ↑ a b Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 495, ISBN 978-3-906390-29-1.
- ↑ Wittstein, M: On a New Cinchona Bark and Its Alkaloid, Cinchonidine. In: American Journal of Pharmacy. Nr. 115. Philadelphia März 1857 (proquest.com).
- ↑ Lueger, Otto; In: Lexikon der gesamten Technik, 1904, S. 142–146.
- ↑ L.F.Fieser, M.Fieser; In: Lehrbuch der organischen Chemie; 3. Auflage, Verlag Chemie, 1957, S. 300.
- ↑ H. J. Wynberg; In: J. Am. Chem. Soc., 1981, 103, S. 417–430.
