Caesiumhydroxid, CsOH, ist das Hydroxid des Caesiums. Es ist in wässriger Lösung eine der stärksten Basen.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Cs+ _ OH− | |||||||||||||||||||
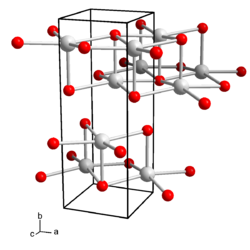
| Kristallsystem |
orthorhombisch | ||||||||||||||||||
| Raumgruppe |
Cmcm (Nr. 63) | ||||||||||||||||||
| Gitterparameter |
a = 4,35 Å, b = 11,99 Å und c = 4,516 Å | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Caesiumhydroxid | ||||||||||||||||||
| Verhältnisformel | CsOH | ||||||||||||||||||
| Kurzbeschreibung |
weiße bis gelbe hygroskopische Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 149,92 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
sehr leicht in Wasser (3000 g·l−1 bei 30 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 2 mg·m−3 (gemessen als einatembarer Staub)[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenCaesiumhydroxid entsteht neben Wasserstoff bei der äußerst heftigen Reaktion (Explosionsgefahr) von Wasser mit Caesium:
Eine weitere Synthesemöglichkeit ist durch die Reaktion von Caesiumoxid mit Wasser gegeben.
Während der Vermischung können heftige Reaktionen auftreten.
Analog zum Rubidiumhydroxid ist auch das Caesiumhydroxid über das Sulfat zugänglich:
Das entstehende Bariumsulfat fällt quantitativ aus und die Caesiumhydroxidlösung kann nach der Filtration vorsichtig zunächst über Kaliumhydroxid in einer Platin-Schale eingeengt werden, bis sich das Salz abscheidet. Dieses wird schließlich in einem Silber-Schiffchen im trockenen Wasserstoff-Strom langsam auf 300 °C erhitzt.[4]
Eigenschaften
BearbeitenWässrige Lösungen von Caesiumhydroxid reagieren stark basisch und ätzen Glas. Caesiumhydroxid kristallisiert orthorhombisch, Raumgruppe Cmcm (Raumgruppen-Nr. 63), mit den Gitterparametern a = 4,35 Å, b = 11,99 Å und c = 4,516 Å.[5] In der Kristallstruktur wird jedes Caesium-Kation von fünf Hydroxid-Anionen koordiniert, die Anionen koordinieren ihrerseits fünf Caesium-Ionen, so dass sich eine Schichtstruktur ergibt. Es sind auch Hydrate des Caesiumhydroxids bekannt. Das Monohydrat kristallisiert tetragonal, Raumgruppe I41/amd (Nr. 141)[6]. Es sind auch hexagonale Formen des Monohydrats beobachtet worden. Das Dihydrat, Cs(OH)·2 H2O kristallisiert orthorhombisch, Raumgruppe Pca21 (Nr. 29).[7] Das Trihydrat ist monoklin mit der Raumgruppe P21/n (Nr. 14, Stellung 2).[7]
Verwendung
BearbeitenDie Caesiumlauge ist eine hochwertige Base zur katalytischen Alkinylierung von Aldehyden und Ketonen.
Caesiumhydroxid wird als Elektrolyt in galvanischen Zellen verwendet.[8]
Einzelnachweise
Bearbeiten- ↑ a b c d e Eintrag zu Cäsiumhydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-57.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Caesiumhydroxid), abgerufen am 4. März 2020.
- ↑ Georg Brauer: Rubidium- und Cäsiumhydroxyd. In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 742.
- ↑ H. Jacobs, B. Harbrecht: Eine neue Darstellungsmethode für Caesiumhydroxid. In: Zeitschrift für Naturforschung B. 36, 1981, S. 270–271 (online).
- ↑ R. Černy, V. Favre-Nicolin, B. Bertheville: A tetragonal polymorph of caesium hydroxide monohydrate, CsOH·H2O, from X-ray powder data. In: Acta Crystallographica, C58, 2002, S. i31–i32, doi:10.1107/S0108270101021928.
- ↑ a b D. Mootz, H. Rütter: Hydrate schwacher und starker Basen. VII: Zum System Caesiumhydroxid-Wasser: Die Kristallstrukturen von CsOH·2 H2O und CsOH·3 H2O. In: Zeitschrift für anorganische und allgemeine Chemie, 608(2), 1992, S. 123–130, doi:10.1002/zaac.19926080218.
- ↑ Eintrag zu Caesium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.


