Ammoniumbromid, NH4Br, bildet hygroskopische, in Aceton, Ethanol und Wasser gut lösliche, kubische Kristalle. Es besitzt einen Sublimationspunkt von 452 °C, eine Dichte von 2,43 g·cm−3 und eine relative Molekülmasse Mr von 97,942.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
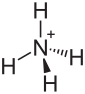 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumbromid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | NH4Br | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, geruchloser, schwach hygroskopischer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 97,94 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,43 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sublimationspunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Synthese
BearbeitenDie Herstellung von Ammoniumbromid kann durch Einwirkung von Bromwasserstoff[3] auf Ammoniak erfolgen:
Die direkte Reaktion von Ammoniak mit Brom in Wasser ergibt ebenfalls das Salz.[2]
Eine weitere Herstellmöglichkeit ist die Umsetzung von Ammoniak mit Eisen(II)-bromid.[2]
Eigenschaften
BearbeitenAmmoniumbromid bildet schwach gelbe Kristalle oder Pulver, die bei Normaldruck bei 452 °C sublimieren.[2] In einer geschlossenen Kapillare wird ein Schmelzpunkt bei 542 °C beobachtet.[2] Das Salz ist sehr gut löslich in Wasser. Die Lösung reagiert sauer. Die Löslichkeit steigt mit steigender Temperatur.[2] Die Verbindung löst sich gut in Ethanol und Aceton.[2]
Löslichkeit in Wasser[2] Temperatur in °C 0 20 40 60 80 100 Löslichkeit in g/100 g H2O 59,5 74,2 89,8 105 117 135
Verwendung
BearbeitenVerwendung findet Ammoniumbromid in der phototechnischen Industrie und in der Medizin als Beruhigungsmittel. Ammoniumbromid kann außerdem als Bromid-Quelle in elektrochemischen Bromierungen fungieren.[7]
Einzelnachweise
Bearbeiten- ↑ a b c d e Eintrag zu Ammoniumbromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Dezember 2022. (JavaScript erforderlich)
- ↑ a b c d e f g h D. Yoffe, R. Frim, S.D. Ukeles, M.J. Dagani, H.J. Barda, T.J. Benya, D.C. Sanders: Bromine Compounds. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH, Weinheim 2013, doi:10.1002/14356007.a04_405.pub2.
- ↑ a b Eintrag zu Ammoniumbromid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- ↑ Delegierte Verordnung (EU) 2022/692 der Kommission vom 16. Februar 2022 zur Änderung der Verordnung (EG) Nr. 1272/2008 des Europäischen Parlaments und des Rates über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen zwecks Anpassung an den technischen und wissenschaftlichen Fortschritt
- ↑ Eintrag zu Ammonium bromide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 16. Dezember 2022. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Ammoniumbromid bei Sigma-Aldrich, abgerufen am 20. Mai 2024 (PDF).
- ↑ Xiang Yang, Qi-Liang Yang, Xiang-Yang Wang, Hao-Han Xu, Tian-Sheng Mei: Copper-Catalyzed Electrochemical Selective Bromination of 8-Aminoquinoline Amide Using NH4Br as the Brominating Reagent. In: The Journal of Organic Chemistry. Band 85, Nr. 5, 6. März 2020, S. 3497–3507, doi:10.1021/acs.joc.9b03223 (englisch).

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9fd9553a0b623f5f669641be907d9186e35b739)

