Als Dimroth-Umlagerung wird eine Umlagerungsreaktion von von exo- und endo-cyclischen Heteroatomen in heterocyclischen Ringen bezeichnet. Der Begriff wurde in den 1960er Jahren zu einer Namensreaktion der organischen Chemie. Exo- und endo-cyclische Heteroatome (zumeist Stickstoffatome) wechseln hierbei ihre Position. Die Reaktion wurde zum ersten Mal im Jahr 1909 von Otto Dimroth beobachtet und publiziert.[1][2][3]
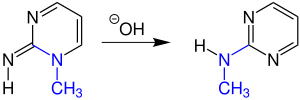
Auch 1H-1,2,3-Triazole können die Dimroth-Umlagerung eingehen.[4] Meist läuft die Reaktion bei sechsgliedrigen Ringen ab, jedoch ist sie auch an fünfgliedrigen Ringen durchführbar.[5]
Mechanismus
BearbeitenUnter basischen Bedingungen reagiert ein Pyrimidinderivat zu einem umgelagerten Pyrimidinderivat. Im folgenden Beispiel hat dabei ein Stickstoffatom (genauer: NR) aus dem Ring die Postion mit dem Stickstoffatom der Imingruppe gewechselt:
Das Hydroxidionen greift am Kohlenstoffatom in Position 6 des Pyrimidin-Derivats 1 an. Dabei bildet sich das Anion 2 welches zum Enol-Intermediat 3 umlagert. Durch einen [1,7]-Protonentransfer entsteht das Alkoholat 4, welches durch Elektronenumlagerung eine Carbonylgruppe ausbildet. Über eine Zwischenstufe bildet sich dann das Imidamid-Intermediat 5. Aus 5 kann sich durch erneute Elektronenpaarumlagerung dann das Amidion 6 bilden, das nun mit dem negativ geladenen Stickstoffatom einen nucleophilen Angriff auf das Kohlenstoffatom der Carbonylgruppe durchführt, wodurch sich das heterocyclische Alkoholat-Intermediat 7 bildet. Das Alkoholat 7 wird durch Wasser zum Alkohol 8 protoniert. Durch Wasserabspaltung entsteht schließlich das Pyrimidin-Derivat 9.
Beispiele
BearbeitenMit Hilfe eines Beispiels soll hier nun die breite Anwendbarkeit der Dimroth-Umlagerung verdeutlicht werden.
Durch die Dimroth-Umlagerung können auch komplexere Reste ihre Position im Molekül verändern. Exemplarisch soll dies hier an Hand eines Pyrimidin-Derivates gezeigt werden, an welchem ein chlorierter Phenylrest umgelagert wird:[6]
Auch 1,2,3-Triazole können, wie bereits weiter oben erwähnt eine Dimroht-Umlagerung eingehen. Dies ist im folgenden Beispiel dargestellt. Ar bezeichnet hierbei einen Arylrest:
Die Triazole müssen eine Amino-Gruppe in der 5-Position tragen. Nach der Ringöffnung zu einer Diazo-Zwischenstufe und einer C-N-Bindungsdrehung wird ein umgelagertes Triazol erhalten.
Siehe auch
BearbeitenWeblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Otto Dimroth: Über intramolekulare Umlagerungen. Umlagerungen in der Reihe des 1, 2, 3-Triazols. Liebigs Annalen, 1909, 364, 183-226, doi:10.1002/jlac.19093640204.
- ↑ Otto Dimroth, Walter Michaelis: Intramolekulare Umlagerung der 5-Amino-1,2,3-triazole. Liebigs Annalen 1927, 459, 39-46, doi:10.1002/jlac.19274590104.
- ↑ Otto Dimroth: Über eine Synthese von Derivaten des 1.2.3-Triazols. Berichte der deutschen chemischen Gesellschaft 1902, 35, 1029-1038, doi:10.1002/cber.190203501171.
- ↑ a b Z. Wang: Comprehensive Organic Name Reactions and Reagents, 1 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 906.
- ↑ Z. Wang: Comprehensive Organic Name Reactions and Reagents, 1 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 905.
- ↑ Reto W. Fischer and Marian Misun: Large-Scale Synthesis of a Pyrrolo[2,3-d]pyrimidine via Dakin−West Reaction and Dimroth Rearrangement. In: Organic Process Research & Development. Band 5, Nr. 6, 2001, S. 581–586, doi:10.1021/op010041v.
[[Kategorie:Namensreaktion]] [[Kategorie:Umlagerung]]