Phytoen-Desaturase
Phytoen-Desaturasen sind an der Carotinoid-Biosynthese beteiligte Enzyme aus der Gruppe der Desaturasen. Sie katalysieren die Dehydrogenierung von 15-cis-Phytoen. Unterschieden wird zwischen bakteriellen und pilzliche Phytoen Desaturasen (CRTI) und pflanzlichen und cyanobakteriellen Phytoen Desaturasen (PDS). CRTI katalysiert die Umwandlung von Phytoen direkt zu all-trans-Lycopin.[3] Die komplette Umwandlung in Pflanzen und Bakterien erfolgt über vier Enzyme (PDS, ζ-Carotin Isomerase, ζ-Carotin Desaturase, Cis-Trans Isomerase),[4] von denen PDS den ersten Schritt zum ζ-Carotin katalysiert.[5]
| Pflanzliche Phytoen Desaturase | ||
|---|---|---|
| ||
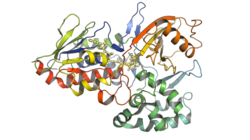
| Kristallografische Struktur der Phytoen Desaturase aus Reis.[1] | ||
|
Vorhandene Strukturdaten: 5MOG | ||
| Masse/Länge Primärstruktur | 491 Aminosäuren | |
| Kofaktor | FAD | |
| Bezeichner | ||
| Gen-Name(n) | PDS | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.3.5.5, Oxidoreduktase | |
| Reaktionsart | Dehydrogenierung | |
| Substrat | 15-cis-Phytoen | |
| Produkte | 9,15,9'-tri-cis-ζ-Carotin | |
| Vorkommen | ||
| Übergeordnetes Taxon | Pflanzen | |
| Bakterielle Phytoen Desaturase | ||
|---|---|---|

| ||
| Kristallografische Struktur der Phytoen Desaturase aus Pantoea ananatis.[2] | ||
|
Vorhandene Strukturdaten: 4DGK | ||
| Masse/Länge Primärstruktur | 501 Aminosäuren | |
| Bezeichner | ||
| Gen-Name(n) | CRTI | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.3.99.31, Oxidoreduktase | |
| Reaktionsart | Dehydrogenierung | |
| Substrat | 15-cis-Phytoen | |
| Produkte | all-trans-z-Lycopin | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Bakterien | |
Biochemie
BearbeitenBei der Umwandlung von 15-cis-Phytoen in all-trans-Lycopin werden insgesamt vier neue Doppelbindungen ins Substrat-Molekül eingeführt.[4] Die Oxidation des Phytoens erfolgt dabei unter Reduktion von FAD, welches sowohl in bakteriellen[6] als auch in pflanzlichen[1] Phytoen Desaturasen enthalten ist. Während CRTI den gesamten biochemischen Pfad zu Lycopin darstellt, erfolgt bei PDS lediglich die Katalyse zu 9,15,9'-tri-cis-ζ-Carotin. Dabei werden an Position 11 und 11' der symmetrischen Kohlenstoffkette zwei neue Doppelbindungen eingeführt und an Positionen 9 und 9' die Doppelbindungen von trans nach cis isomerisiert. Die bei dieser Reaktion entfernten Elektronen werden über FAD an Plastochinon abgeführt[7] und über terminale Oxidasen letztlich zur Sauerstoff-Reduktion genutzt.
Verwendung
BearbeitenEinige Herbizide wie Norflurazon, Diflufenican und Picolinafen wirken durch Hemmung der PDS.[8] Dabei blockiert das Herbizid die Bindestelle von Plastochinon innerhalb des Enzyms.[1] Da das Ausschalten des PDS-Gens in Pflanzen ein Ausbleichen der Pflanze bewirkt,[9] wurde dieser Effekt zur Präsentation von effizienter Genomeditierung mittels CRISPR/Cas9 genutzt.[10][11]
Im Goldenen Reis wurde neben einer Phytoensynthase und Lycopincyclase aus der Narzisse das Gen einer bakteriellen Phytoen Desaturase in das Reisgenom integriert.[12]
Einzelnachweise
Bearbeiten- ↑ a b c Anton Brausemann, Sandra Gemmecker, Julian Koschmieder, Sandro Ghisla, Peter Beyer, Oliver Einsle: Structure of Phytoene Desaturase Provides Insights into Herbicide Binding and Reaction Mechanisms Involved in Carotene Desaturation. In: Structure. Band 25, Nr. 8, 2017, S. 1222–1232.E3, doi:10.1016/j.str.2017.06.002, PMID 28669634.
- ↑ Patrick Schaub, Qiuju Yu, Sandra Gemmecker, Pierre Poussin-Courmontagne, Justine Mailliot, Alastair G. McEwen, Sandro Ghisla, Salim Al-Babili, Jean Cavarelli, Peter Beyer: On the Structure and Function of the Phytoene Desaturase CRTI from Pantoea ananatis, a Membrane-Peripheral and FAD-Dependent Oxidase/Isomerase. In: PLoS One. Band 7, Nr. 6, 2012, S. e39550, doi:10.1371/journal.pone.0039550, PMID 22745782, PMC 3382138 (freier Volltext).
- ↑ P. D. Fraser, N. Misawa, H. Linden, S. Yamano, K. Kobayashi: Expression in Escherichia coli, purification, and reactivation of the recombinant Erwinia uredovora phytoene desaturase. In: The Journal of Biological Chemistry. Band 267, Nr. 28, 5. Oktober 1992, ISSN 0021-9258, S. 19891–19895, PMID 1400305.
- ↑ a b Alexander R. Moise, Salim Al-Babili, Eleanore T. Wurtzel: Mechanistic aspects of carotenoid biosynthesis. In: Chemical Reviews. Band 114, Nr. 1, 8. Januar 2014, ISSN 1520-6890, S. 164–193, doi:10.1021/cr400106y, PMID 24175570.
- ↑ P D Fraser, H Linden, G Sandmann: Purification and reactivation of recombinant Synechococcus phytoene desaturase from an overexpressing strain of Escherichia coli. In: Biochemical Journal. Band 291, Nr. 3, 1. Mai 1993, ISSN 0264-6021, S. 687–692, PMID 8489496.
- ↑ T. A. Dailey, H. A. Dailey: Identification of an FAD superfamily containing protoporphyrinogen oxidases, monoamine oxidases, and phytoene desaturase. Expression and characterization of phytoene desaturase of Myxococcus xanthus. In: The Journal of Biological Chemistry. Band 273, Nr. 22, 29. Mai 1998, ISSN 0021-9258, S. 13658–13662, PMID 9593705.
- ↑ S. R. Norris, T. R. Barrette, D. DellaPenna: Genetic dissection of carotenoid synthesis in arabidopsis defines plastoquinone as an essential component of phytoene desaturation. In: The Plant Cell. Band 7, Nr. 12, Dezember 1995, ISSN 1040-4651, S. 2139–2149, doi:10.1105/tpc.7.12.2139, PMID 8718624, PMC 161068 (freier Volltext).
- ↑ Thomas Seitz, Michael G. Hoffmann, Hansjörg Krähmer: Herbizide für die Landwirtschaft: Chemische Unkrautbekämpfung. In: ChiuZ. Band 37, Nr. 2, 2003, S. 118, doi:10.1002/ciuz.200300279.
- ↑ Genji Qin, Hongya Gu, Ligeng Ma, Yiben Peng, Xing Wang Deng: Disruption of phytoene desaturase gene results in albino and dwarf phenotypes in Arabidopsis by impairing chlorophyll, carotenoid, and gibberellin biosynthesis. In: Cell Research. Band 17, Nr. 5, 2007, ISSN 1748-7838, S. 471–482, doi:10.1038/cr.2007.40, PMID 17486124.
- ↑ Chikako Nishitani, Narumi Hirai, Sadao Komori, Masato Wada, Kazuma Okada: Efficient Genome Editing in Apple Using a CRISPR/Cas9 system. In: Scientific Reports. Band 6, 2016, ISSN 2045-2322, S. 31481, doi:10.1038/srep31481, PMID 27530958, PMC 4987624 (freier Volltext).
- ↑ Ikuko Nakajima, Yusuke Ban, Akifumi Azuma, Noriyuki Onoue, Takaya Moriguchi: CRISPR/Cas9-mediated targeted mutagenesis in grape. In: PloS One. Band 12, Nr. 5, 2017, ISSN 1932-6203, S. e0177966, doi:10.1371/journal.pone.0177966, PMID 28542349, PMC 5436839 (freier Volltext).
- ↑ Peter Schopfer: Pflanzenphysiologie. Elsevier, Spektrum Akademischer Verlag, München 2010, ISBN 978-3-8274-2351-1, S. 382–383.