Als Aminosäuresequenz, auch Peptidsequenz oder Proteinsequenz, wird die Abfolge der verschiedenen Aminosäuren in einem Peptid bezeichnet, insbesondere der Polypeptidkette eines Proteins.
Die Aminosäuresequenz gibt Auskunft darüber, aus welchen Aminosäuren ein Peptid oder Protein aufgebaut ist und in welcher Reihenfolge die einzelnen Aminosäure-Bausteine durch Peptidbindungen miteinander verknüpft sind; sie stellt die Primärstruktur eines Proteins dar.
| Aminosäuresequenz von Angiotensin II, ein Octapeptid |
|---|
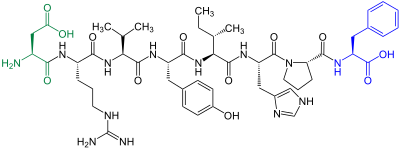 Strukturformel |
 Dreibuchstaben-Code |
| DRVYIHPF
Einbuchstabe-Code |
Darstellungsmöglichkeiten
BearbeitenDie Darstellung der Aminosäuresequenz eines Peptids ist in unterschiedlichen Abstraktionsgraden möglich. Eine Variante besteht darin, die Sequenz der Aminosäuren mithilfe chemischer Strukturformeln darzustellen, wobei die Stereochemie kenntlich gemacht werden kann.[1]
Häufiger wird die Aminosäuresequenz durch Symbole des Dreibuchstaben- oder Einbuchstabe-Codes angegeben. Beim Dreibuchstaben-Code wird eine Aminosäure durch drei Buchstaben dargestellt; die Peptidbindungen werden durch Verbindungslinien symbolisiert. Beim Einbuchstabe-Code steht jeweils ein Buchstabe für die jeweilige Aminosäure. Sofern nicht anders gekennzeichnet, ist eine L-Aminosäure gemeint. Die Aminosäuresequenz wird mit der N-terminalen Aminosäure links beginnend notiert. Die Schreibrichtung vom N-Terminus zum C-Terminus entspricht der Abfolge im natürlichen Syntheseprozess der Proteine an den Ribosomen im Zuge der Translation.
Ausdruck genetischer Information
BearbeitenAlle Zellen können im Rahmen der ribosomalen Proteinbiosynthese schrittweise ausgewählte Aminosäuren durch Peptidbindungen zur Kette eines bestimmten Polypeptids verknüpfen. Art und Position von Aminosäuren in dessen Aminosäuresequenz sind dabei bestimmt durch die im vorliegenden mRNA-Strang wiedergegebene genetische Information: die Art und Position von Nukleobasen in dessen Nukleotidsequenz. Mithilfe von tRNA-Molekülen werden jeweils die Basen dreier Nukleotide – ein Basentriplett – als Codon gelesen und in eine bestimmte Aminosäure übersetzt, entsprechend dem genetischen Code. Bei diesem Prozess der Translation entspricht einer bestimmten Basensequenz der mRNA damit eine bestimmte Aminosäuresequenz im Protein.
Im vorausgehenden Prozess der Transkription wurde hierfür der RNA-Strang durch eine RNA-Polymerase anhand der Vorlage eines bestimmten DNA-Abschnitts aufgebaut und dessen Basensequenz so in die einer RNA umgeschrieben. Von der Sequenz eines für Proteine codierenden DNA-Abschnitts kann damit über den codierenden RNA-Abschnitt auf die Aminosäuresequenz des gebildeten Proteins geschlossen werden. Da aber mehrere Codons für die gleiche Aminosäure stehen können, ist der umgekehrte Schluss nicht eindeutig möglich.[2]
Grundstruktur von Proteinen
BearbeitenDie Aminosäuresequenz stellt die Primärstruktur von Proteinen dar. Sie gibt die Abfolge der Grundbausteine des Biopolymers an: welche Aminosäuren in welcher Reihenfolge miteinander zum Polypeptid verbunden sind. Gewöhnlich sind dies α-Aminosäuren in einer linearen Sequenz, deren Enden als Carboxy- oder C-Terminus bzw. als Amino- oder N-Terminus bezeichnet werden. Zwischen der C-terminalen und der N-terminalen sind α-Aminosäuren jeweils mit zwei C-Atomen über Peptidbindungen in die Hauptkette eingebunden, während ihre Reste verschiedene Seitenketten bilden. Die Hauptkette des Polypeptids bildet das Rückgrat (Backbone) des Proteins und sichert den inneren kovalenten Zusammenhalt des Makromoleküls. Die je nach Aminosäuresequenz unterschiedlichen Seitenketten bestimmen bei der Proteinfaltung im Zellmilieu höhere Strukturebenen eines Proteins (Sekundärstruktur, Tertiärstruktur, Quartärstruktur).
Bereits während der Translation bilden sich auf Teilen der Primärstruktur sekundäre Strukturen infolge der Wechselwirkungen zwischen den Seitenketten der Aminosäuren. Oft nehmen diese schon eine endgültige Form an, in einigen Fällen sind an dem Faltungsprozess zusätzlich noch Enzyme (Chaperone genannt), posttranslationale Modifikationen und Umgebungseinflüsse (z. B. bei Prionen) beteiligt. Aus der Sekundärstruktur geht die räumliche Strukturerfüllung (Tertiärstruktur) hervor und daraus gegebenenfalls die Komplexierung mit anderen Untereinheiten zu Proteinkomplexen (Quartärstruktur).
Zurzeit existiert noch keine zuverlässige Methode, anhand der Primärstruktur die exakte räumliche Anordnung einer Aminosäurekette vorherzusagen. Aus Erfahrungswerten lassen sich aber Aussagen über besondere Strukturelemente herleiten und darüber auch hinsichtlich vermutlicher Funktionen des Proteins. Die Aminosäuresequenz kann durch eine Proteinsequenzierung bestimmt werden. Im Zuge eines Proteindesigns kann die Aminosäuresequenz gezielt geändert werden, um die Eigenschaften des Proteins zu verändern.
Einzelnachweise
Bearbeiten- ↑ Hans-Dieter Jakubke: Peptide – Chemie und Biologie., Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin/New York, 1996, ISBN 3-8274-0000-7.
- ↑ Georg Löffler, Petro Petrides, Peter Heinrich: Biochemie und Pathobiochemie, 8. Auflage, Springer Medizin Verlag, Heidelberg, 2007, S. 289, ISBN 978-3-540-32680-9.