Zinkhexafluorosilicat
Zinkhexafluorosilicat mit der Summenformel Zn[SiF6] ist eine anorganische chemische Verbindung des Zinks aus der Gruppe der Hexafluorosilicate.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
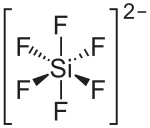
| ||||||||||
| Allgemeines | ||||||||||
| Name | Zinkhexafluorosilicat | |||||||||
| Andere Namen |
Zinksilicofluorid | |||||||||
| Summenformel | Zn[SiF6] | |||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 207,46 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
2,104 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
leicht löslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung Bearbeiten
Zinkhexafluorosilicat kann durch Reaktion von Zinkoxid mit Hexafluorokieselsäure gewonnen werden.[3][4]
Eigenschaften Bearbeiten
Zinkhexafluorosilicat ist ein kristalliner weißer geruchloser Feststoff, der leicht löslich in Wasser ist. Er zersetzt sich bei Erhitzung über 100 °C, wobei Fluorwasserstoffgas und Siliciumfluoride entstehen.[1] Das Hexahydrat mit der Formel Zn[SiF6] · 6 H2O bildet farblose, hexagonale Prismen[5] und besitzt eine Kristallstruktur mit der Raumgruppe R3 (Raumgruppen-Nr. 148).[6] Dabei ist Zink oktaedrisch von Wassermolekülen umgeben, die Wasserstoffbrückenbindungen zu den SF6-Oktaedern ausbilden. Dadurch entsteht eine rhomboedrisch-verzerrte Caesiumchloridstruktur.[6]
Verwendung Bearbeiten
Zinkhexafluorosilicat wird als Wasserdichtmachen (Fluatieren) von Zement, in Kombination mit anderen Fluoriden zur Erhöhung der Korrosionsbeständigkeit der Oberflächen von Aluminium und Aluminiumlegierungen, in der Textilindustrie als Härtungsbeschleuniger für Imprägnierlösungen auf Melamin- und Harnstoffharzbasis und im Holzschutz als Fungizid verwendet.[5] So wird es als Bestandteil von sogenannten CKF- und CKFZ-Salzen (Holzschutzmittel-Wirkstoffe, die neben den Chrom- oder Kupfersalzen zusätzlich Fluorverbindungen wie eben zum Beispiel Kupferhexafluorosilicat oder Zinkhexafluorosilicat enthalten) eingesetzt.[7]
Sicherheitshinweise Bearbeiten
Zinkhexafluorosilicat ist giftig und kann bei oraler Aufnahme durch Elektrolytentgleisungen und Azidose tödlich wirken.[8]
Einzelnachweise Bearbeiten
- ↑ a b c d e f g h Eintrag zu Zinkhexafluorosilikat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Februar 2023. (JavaScript erforderlich)
- ↑ Nicholas P. Cheremisinoff: Handbook of Industrial Toxicology and Hazardous Materials. CRC Press, 1999, ISBN 978-0-8247-1935-7, S. 169 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Zinc Silicofluoride in der Hazardous Substances Data Bank (via PubChem), abgerufen am 23. November 2016.
- ↑ Dietrich Breitinger, Wolfgang A. Herrmann, Wolfgang Hiller: Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 5, 1999 Volume 5: Copper, Silver, Gold, Zinc, Cadmium and Mercury. Georg Thieme Verlag, 2014, ISBN 3-13-179211-6, S. 134 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Eintrag zu Zinkhexafluorosilicat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. November 2016.
- ↑ a b S. Ray, A. Zalkin, D. H. Templeton: Crystal structures of the fluosilicate hexahydrates of cobalt, nickel and zinc. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 29, 1973. S. 2741–2747, doi:10.1107/S056774087300748X.
- ↑ schadstoffberatung.de: Holzschutz, abgerufen am 23. November 2016
- ↑ C. Marx, S. Trautmann, M. Halank, M. Weise: Letale Intoxikation mit Zinkhexafluorosilikat (Flusssäure). In: Intensivmedizin und Notfallmedizin. 43, 2006, S. 209, doi:10.1007/s00390-006-0669-2.

