SNARE (Protein)
SNARE-Komplexe (Engl. Abkürzung für: soluble N-ethylmaleimide-sensitive-factor attachment receptor) sind Proteinkomplexe in Vesikeln von eukaryotischen Zellen. Die Untereinheiten dieser Komplexe werden entsprechend SNARE-Proteine genannt. SNARE-Komplexe katalysieren bei der Fusion von biologischen Membranen den Transport von small molecules, beispielsweise bei einer Exozytose in den synaptischen Spalt.
| Übergeordnet |
| Zellmembran |
| Gene Ontology |
|---|
| QuickGO |
Eigenschaften Bearbeiten
SNARE-Komplexe kommen bei Eukaryoten in allen sezernierenden Zellen vor. Nervenzellen beispielsweise bewahren ihre Neurotransmitter fertig synthetisiert in synaptischen Vesikeln gesammelt auf. Sollen die Transmitter außerhalb der Zelle freigesetzt werden, muss das Vesikel mit der Membran fusionieren und eine Pore gebildet werden, durch die die Transmitter-Moleküle nach außen gelangen. Die Fusion und Öffnung des Vesikels wird von SNARE und anderen Proteinen (Myosin II) kontrolliert.[1]
Die Transportgleichung lautet:
- Neurotransmitter (Vesikel) Neurotransmitter (extrazellulär)
Beim Menschen sind neun SNARE-Proteine bekannt: Synaptobrevin-1 und -2, Syntaxin-1A und -4, Snapin, SNAP-23 und -25, Endobrevin und Vesikelfusionsprotein NSF. Aus drei bis fünf verschiedenen dieser Proteine werden mindestens ein Dutzend verschiedene SNARE-Komplexe gebildet.[1][2]
Struktur Bearbeiten
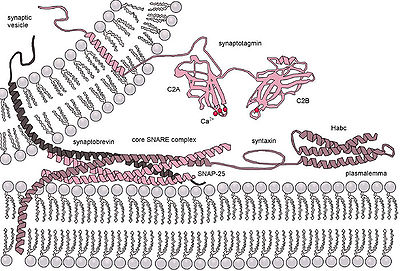
Die SNARE-Proteine bilden sehr stabile Komplexe, welche jeweils aus vier parallel, in sog. „Coiled-Coils“ angeordneten α-Helices mit einem 60-70 Aminosäuren umfassenden SNARE-Motiv bestehen. Das Innere dieses Kernkomplexes wird (senkrecht zur Verdrillungsachse) aus 16 Schichten hydrophober Aminosäuren gebildet. Eine Ausnahme bildet der mittlere „0-layer“, der von drei Glutaminen (Q) und einem Arginin (R) – also Aminosäuren mit polaren Seitenketten – gebildet wird. Abhängig von ihrer Position im Kernkomplex unterscheidet man Qa-, Qb-, Qc- und R-SNAREs, die evolutionär hochkonserviert sind. Man geht davon aus, dass ein funktioneller SNARE-Komplex die Zusammensetzung QabcR haben muss. Manche der SNAREs sind Transmembranproteine, von denen in beiden der zu fusionierenden Membranen mindestens eines vorkommen muss.
Aufgabe und Funktion Bearbeiten
Angesiedelt auf der Vesikeloberfläche (v-SNARE = vesicle synaptosome-associated protein receptor) sowie dem Ziel-Organell (t-SNARE = target synaptosome-associated protein receptor) sorgen sie für das korrekte Eintreten von Fusionen, weil jedes Organell bzw. Vesikel eine spezifische SNARE-Komposition hat. Die Verschmelzung erfolgt auf molekularen Reiz hin (z. B. Erhöhung der Ca2+-Konzentration mit Synaptotagmin als Sensorprotein); bei der Fusion muss Wasser von der hydrophilen (wasserliebenden) Vesikeloberfläche verdrängt werden, was energetisch äußerst ungünstig ist und so der Spezifität dient, wenn nämlich nur bei korrekter v- und t-SNARE-Kombination ausreichend Energie durch die Protein-Interaktion frei wird. Neben den SNAREs spielen auch Rab-Proteine eine Rolle bei der gerichteten Fusion von Vesikel und Organell.
Die erfolgende Fusion liefert dem Organell dann nicht nur die Inhaltsstoffe des Vesikels, sondern auch neue Membranlipide.
SNAREs als Ziel von Neurotoxinen Bearbeiten
Tetanustoxin und Botulinumtoxin (Botox) spielen eine Rolle bei der Blockade von Synapsen. Sie spalten SNARE-Proteine, wodurch die Vesikelfusion und somit die Transmitterfreisetzung verhindert wird. Ein Tetanus-Krampf entsteht, wenn Tetanustoxin hemmende Synapsen blockiert. Es gibt sieben bekannte Botulinumtoxine, eines davon namens Toxin A. Dieses große Protein besteht aus zwei Teilen, wobei der kürzere als Endopeptidase wirkt. Diese spaltet hydrolytisch das SNAP-25-Protein, das in der präsynaptischen Membran sitzt. Botox blockiert z. B. erregende Synapsen.
Weblinks Bearbeiten
Einzelnachweise Bearbeiten
- ↑ a b 1.F.1 The Synaptosomal Vesicle Fusion Pore (SVF-Pore) Family. In: TCDB. Saier Lab Bioinformatics, abgerufen am 8. September 2010 (englisch).
- ↑ GO:0031201 SNARE complex (children). In: Gene Ontology. EBI, abgerufen am 8. September 2010 (englisch).