Hagemann-Ester
Der Hagemann-Ester ist ein Carbonsäureester, der neben der Esterfunktion auch über eine Ketonfunktion verfügt. Die Verbindung eignet sich als Zwischenprodukt zur Herstellung diverser Naturstoffe, beispielsweise mehrerer Terpene.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
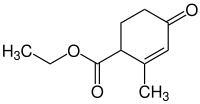
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hagemann-Ester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H14O3 | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgelbe, klare Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 182,22 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,078 g·cm−3 bei 27 °C[1] | ||||||||||||||||||
| Siedepunkt |
268–272 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte Bearbeiten
Die erste Publikation zu der Verbindung stammt aus dem Jahr 1893 mit Ergebnissen aus Carl Hagemanns Doktorarbeit.[2] Hergestellt wurde sie damals aus Ethylacetoacetat durch Umsetzung mit Diiodmethan und Natriummethanolat. 1894 klärte Emil Knoevenagel die Struktur eindeutig auf. Später wurden weitere Synthesen entwickelt und die Bezeichnung Hagemann-Ester kam auf.[3]
Herstellung Bearbeiten
In der ursprünglichen Methode nach Hagemann werden zwei Äquivalente Ethylacetoacetat und ein Äquivalent Diiodmethan mit Natriummethanolat umgesetzt. Dadurch entsteht zunächst Methylenbisacetessigester, der zum Hagemann-Ester cyclisiert.[4]
In der Methode nach Knoevenagel werden unter Katalyse von Piperidin zwei Moleküle Ethylacetoacetat mit Formaldehyd kondensiert.[4]
In der Methode nach Newman und Lloyd werden 2-Methoxy-1,3-butadien und Ethyl-2-butinoat in einer Diels-Alder-Reaktion umgesetzt und das Reaktionsprodukt zum Hagemann-Ester hydrolysiert.[4]
In der Methode nach Mannich und Fourneau wird in situ aus Diethylmethyl-(3-oxobutyl)ammoniumiodid das Methylvinylketon gewonnen, welches mit Ethylacetoacetat ein Addukt bildet, das wiederum mit Natriumethanolat cyclisiert wird.[4]
Heute ist der Hagemann-Ester kommerziell erhältlich und wird oft nach der Methode von Knoevenagel hergestellt.[3]
Reaktionen Bearbeiten
Der Hagemann-Ester kann in vielfältigen Reaktionen zu anderen relevanten Verbindungen umgesetzt werden. Verschiedene Reaktionen zur selektiven Alkylierung sind bekannt.[4] Durch Umsetzungen mit Basen und Alkylhalogeniden ergeben sich je nach Reaktionsbedingungen in Position 1 oder 3 substituierte Derivate. Mit Lithiumdimethylcuprat entsteht eine 2,2-Dimethylverbindung. Der Ester und seine Derivate können verseift und decarboxyliert werden. Der Ester kann außerdem zu einem gesättigten Keton hydriert werden. Auch verschiedene Diene für Diels-Alder-Reaktionen, sowie Benzolderivate, Bi- und Tricyclen lassen sich aus Hagemanns Ester herstellen.[3] Verbindungen, die aus dem Hagemann-Ester hergestellt werden können, sind Vermiculin, Pinene, sowie Steroidderivate.[4][5][6]
Abgeleitete Verbindung Bearbeiten
Analog zur Herstellungsmethode nach Mannich kann aus Isopropylacetoacetat und Methylvinylketon ein 1-Isopropylderivat des Hagemann-Esters hergestellt werden. Dieses kann zu Piperiton, Menthol und Thymol umgesetzt werden.[3]
Einzelnachweise Bearbeiten
- ↑ a b c d e f Datenblatt 2-Methyl-4-oxo-2-cyclohexencarbonsäure-ethylester bei Sigma-Aldrich, abgerufen am 29. Februar 2024 (PDF).
- ↑ C. Th. L. Hagemann: Ueber die Einwirkung von Methylenjodid auf Natracetessigäther. In: Berichte der deutschen chemischen Gesellschaft. Band 26, Nr. 1, 1893, S. 876–890, doi:10.1002/cber.189302601181.
- ↑ a b c d Fritz Eiden: Carl Hagemann ...ein Mensch von großer Güte, ein richtiger Chemiker... In: Chemie in unserer Zeit. Band 41, Nr. 4, August 2007, S. 316–323, doi:10.1002/ciuz.200700411.
- ↑ a b c d e f Gian Piero Pollini, Simonetta Benetti, Carmela De Risi, Vinicio Zanirato: Hagemann's ester: a timeless building block for natural product synthesis. In: Tetrahedron. Band 66, Nr. 15, April 2010, S. 2775–2802, doi:10.1016/j.tet.2010.01.078.
- ↑ Yoshiyasu Fukuyama, Curtis L. Kirkemo, James D. White: A novel synthesis of (.+-.)-vermiculine. In: Journal of the American Chemical Society. Band 99, Nr. 2, Januar 1977, S. 646–647, doi:10.1021/ja00444a073.
- ↑ Mullapponmannil Thomas Thomas, Alex G. Fallis: The total synthesis of (+-)-.alpha.- and (+-)-.beta.-pinene. A general route to bicyclic mono- and sesquiterpenes. In: Journal of the American Chemical Society. Band 98, Nr. 5, März 1976, S. 1227–1231, doi:10.1021/ja00421a029.