Unter dem Begriff Kerntransport werden diejenigen Mechanismen, durch die sich Moleküle über die Kernmembran einer Zelle bewegen, zusammengefasst. Der Ein- und Austritt großer Moleküle aus dem Zellkern wird durch die Kernporenkomplexe (nuclear pore complexes, NPCs) streng kontrolliert. Obwohl kleine Moleküle ohne Regulation in den Kern gelangen können,[1] erfordert der Transport von Makromolekülen wie RNA und Proteinen eine Assoziation mit Transportfaktoren, den Kerntransportrezeptoren, etwa den Karyopherinen: sog. Importine für den Ein-, Exportine, für den Austritt aus dem Kern.[2][3]
Proteine, die aus dem Cytoplasms in den Kern importiert werden, tragen Kernlokalisierungssignale (nuclear localization signals, NLS), eine Aminosäuresequenz, die als Tag fungiert, an das Importine binden können. NLS sind unterschiedlich in ihrer Zusammensetzung und meist hydrophil, obwohl auch hydrophobe Sequenzen bekannt sind.[1] Proteine, tRNA und zusammengesetzte ribosomale Untereinheiten werden aufgrund der Assoziation mit Exportinen, die an andere Signalsequenzen binden, die als Kernexportsignale (nuclear export signals, NES) bezeichnet werden, aus dem Kern exportiert. Die Fähigkeit der Importine und Exportine, ihre Fracht zu transportieren, wird durch die kleine, dem Ras verwandte GTPase Ran reguliert.
GTPasen sind Enzyme, die an ein Molekül namens Guanosintriphosphat (GTP) binden, das sie zeitverzögert zu Guanosindiphosphat (GDP) hydrolysieren. Dabei haben sie eine andere Konformation, je nachdem, ob sie an GTP oder GDP gebunden ist. In seinem GTP-gebundenen Zustand kann Ran an Karyopherine (also Importine und Exportine) binden. Importine setzen beim Binden an RanGTP das zu transportierende Molekül frei, während Exportine RanGTP binden müssen, um mit ihrer Exportfracht einen ternären Komplex zu bilden. Der dominante Nucleotidbindungszustand von Ran hängt davon ab, ob er sich im Kern (RanGTP) oder im Cytoplasma (RanGDP) befindet.
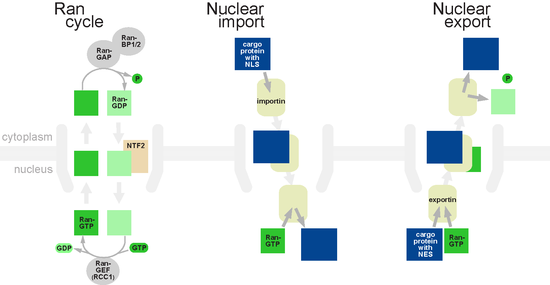
Kernimport
BearbeitenImportine binden zunächst ihre Fracht im Cytoplasma, danach können sie mit dem Kernporenkomplex interagieren und seinen Kanal passieren. Wenn sie sich im Kern befinden, führt die Wechselwirkung mit Ran-GTP zu einer Konformationsänderung des Importins, die dazu führt, dass es sich von seiner Fracht löst.[4] Der resultierende Komplex aus Importin und Ran-GTP tritt dann wieder in das Cytoplasma über, wo ein Protein namens Ran Binding Protein (RanBP) Ran-GTP vom Importin trennt. Die Trennung ermöglicht einem GTPase-aktivierenden Protein (GAP), an Ran-GTP zu binden und die Hydrolyse von GTP zu GDP induzieren. Das entstandene Ran-GDP bindet nun an den Kerntransportfaktor NUTF2, der es in das Nucleoplasma zurücktransportiert. Wieder im Kern interagiert das Ran-GDP mit einem Guanin-Nucleotid-Austauschfaktor (guanine nucleotide exchange factor, GEF), der das GDP durch GTP ersetzt, sodass der Prozess erneut ablaufen kann.
Kernexport
BearbeitenGrob gesagt kehrt der Kernexport den Importprozess um: Im Kern bindet Exportin seine Ladung und an Ran-GTP und diffundiert anschließend durch eine Kernpore ins Cytoplasma, wo der Komplex dissoziiert. Dort bindet Ran-GTP an GAP und hydrolysiert GTP. Nach dem Rücktransport in den Kern wird GDP durch GTP ausgetauscht und damit das Exportin reaktiviert. Während Importine von Ran-GTP abhängen, um sich von ihrer Fracht zu trennen, benötigen Exportine Ran-GTP, um an ihre Fracht zu binden.[5]
Reife mRNA wird von einem spezialisierten mRNA-Transportprotein transportiert. Dieser Prozess ist noch nicht im Detail verstanden, bekannt ist aber, dass Ran darin eine Rolle spielt. Manche besonders häufig transkribierten Gene liegen in der Nähe von Kernporen, um den Transport zu beschleunigen.[6]
Der Export von tRNA hängt von verschiedenen Modifikationen ab, die sie im Kern erfährt, wodurch der Export von nicht ordnungsgemäß funktionierender tRNA verhindert wird. Diese Qualitätsprüfung ist aufgrund der zentralen Rolle der tRNA bei der Translation, wo es an der Elongation der wachsenden Peptidkette durch anfügen weiterer Aminosäuren beteiligt ist, bedeutend. Der tRNA-Transporter in Wirbeltieren heißt E<i id="mwQQ">xportin-t</i>. Exportin-t bindet direkt an seine tRNA-Fracht im Kern, ein Prozess, der durch die Anwesenheit von RanGTP gefördert wird. Mutationen, die die Struktur der tRNA beeinflussen, beeinträchtigen deren Fähigkeit, an Exportin-t zu binden und damit exportiert zu werden, wodurch die Zelle einen weiteren Qualitätskontrollschritt erhält.[7] Wie bereits beschrieben, dissoziiert dieser Komplex, sobald er die Kernmembran überschritten hat, und setzt die tRNA ins Cytosol frei.
Protein-Shuttling
BearbeitenViele Proteine tragen sowohl ein Kernlokalisierungs- als auch ein Kernexportsignal und pendeln (engl. to shuttle) deswegen ständig zwischen Kern und Cytosol. In machen Fällen ist einer dieser Schritte (d.h. Import oder Export) reguliert, häufig über posttranslationale Modifikationen.
Protein-Shuttling kann unter Verwendung eines Heterokaryon-Fusionsassays quantifiziert werden.[8]
Einzelnachweise
Bearbeiten- ↑ a b ISBN 978-0-8053-9603-4.
- ↑ MT Mackmull, B Klaus, I Heinze, M Chokkalingam, A Beyer, RB Russell, A Ori, M Beck: Landscape of nuclear transport receptor cargo specificity. In: Molecular Systems Biology. 13. Jahrgang, Nr. 12, 18. Dezember 2017, S. 962, doi:10.15252/msb.20177608, PMID 29254951, PMC 5740495 (freier Volltext).
- ↑ ISBN 978-0-8153-3481-1.
- ↑ ISBN 978-0-7167-2672-2.
- ↑ Lucy F. Pemberton: Mechanisms of Receptor-Mediated Nuclear Import and Nuclear Export. Blackwell Munksgaard, S. 187–198.
- ↑ CN Cole, JJ Scarcelli: Transport of messenger RNA from the nucleus to the cytoplasm. In: Curr Opin Cell Biol. 18. Jahrgang, Nr. 3, 2006, S. 299–306, doi:10.1016/j.ceb.2006.04.006, PMID 16682182.
- ↑ Dirk Görlich: Transport between the cell nucleus and the cytoplasm. In: Annu. Rev. Cell Dev. Biol. 15. Jahrgang, 1999, S. 607–660, doi:10.1146/annurev.cellbio.15.1.607, PMID 10611974.
- ↑ Roseann Gammal, Krista Baker, Destin Heilman: Heterokaryon Technique for Analysis of Cell Type-specific Localization. In: Journal of Visualized Experiments. Nr. 49, 2011, ISSN 1940-087X, S. 2488, doi:10.3791/2488, PMID 21445034, PMC 3197295 (freier Volltext).
[[Kategorie:Zellbiologie]]