Asenapin
Asenapin ist ein Arzneistoff aus der Gruppe der atypischen Neuroleptika, der u. a. in der Behandlung von mäßig bis schwer ausgeprägten manischen Phasen bei Patienten mit bipolaren Störungen eingesetzt wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
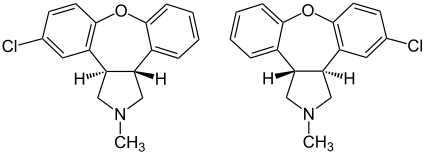
| 1:1-Gemisch aus (3aR,12bR)-Isomer (links) und (3aS,12bS)-Isomer (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Asenapin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C17H16ClNO | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
u. a. Serotonin- und Dopaminantagonist | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 285,77 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben Bearbeiten
Anwendungsgebiete Bearbeiten
In der Europäischen Union (EU) ist Asenapin zur Behandlung von Erwachsenen mit bipolaren Störungen während mäßig bis schwer ausgeprägten manischen Phasen zugelassen.[2] In den USA ist Asenapin zusätzlich zur Behandlung von Schizophrenie zugelassen.[3] In der Schweiz wurde die Zulassung für Asenapin (Handelsname Sycrest) am 19. Juli 2012 durch Swissmedic erteilt.[4]
Asenapin wird sublingual verabreicht: Die Sublingualtablette wird unter die Zunge gelegt, wo sie sich nach wenigen Sekunden vollständig auflöst und der Wirkstoff über den Mundraum aufgenommen wird.[2]
Wirksamkeit Bearbeiten
Klinische Studien zeigten, dass Asenapin manische Symptome in einer Studie über 3 Wochen reduzierte. Dieser Effekt blieb in der manischen Episode über 12 Wochen erhalten.
Die Wirksamkeit von Asenapin ist nach 12 Wochen mit der Wirksamkeit von Olanzapin vergleichbar.[5] Die anhaltende Wirkung von Asenapin wurde für ein volles Jahr gezeigt.[6] In den Zulassungsstudien zeigte Asenapin in der zugelassenen Indikation eine geringere Wirksamkeit als Olanzapin bei nicht verbessertem Sicherheitsprofil. Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) hält einen therapeutischen Vorteil für nicht gegeben. Aufgrund nicht ausreichender Wirksamkeit erhielt Asenapin für die ebenfalls beantragte Indikation Schizophrenie keine Zulassung.[7]
Bei Patienten, die auf eine Monotherapie mit Lithium oder Valproinsäure bei therapeutischen Serumspiegeln teilweise nicht ansprachen, führte die zusätzliche Anwendung von Asenapin als Begleittherapie gegenüber einer Monotherapie mit Lithium oder Valproat zu einer überlegenen Wirksamkeit.[8]
Asenapin wirkt sehr rasch, in klinischen Studien gab es bei Patienten mit Symptomen einer Manie ab Tag 2 eine messbare Wirkung.[9]
Asenapin wird in der unabhängigen Schweizer Fachzeitschrift pharma-kritik 2013 als bezüglich seiner Wirksamkeit bei manischen Episoden zwar wirksamer als Placebo gesehen; ob es jedoch tatsächlich die Wirksamkeit bewährter Medikamente erreiche, scheine bis dahin ungeklärt. Als problematisch wird u. a. die Notwendigkeit gesehen, das Medikament anhand vergleichsweise komplexer Vorgaben einzunehmen. Asenapin solle daher bei manischen Episoden anderen bewährten und preislich vorteilhafteren Neuroleptika nicht vorgezogen werden.[10]
Unerwünschte Wirkungen Bearbeiten
Sehr häufig auftretende Nebenwirkungen sind Schläfrigkeit und Angstgefühle;[11] auch Appetitsteigerung und Gewichtszunahme, Ermüdung, Abstumpfung, Verstimmung, Bewegungsdrang, unwillkürliche Bewegungen, Parkinson-artige Störungen, Schwindel, Geschmacksstörungen, Mundunempfindlichkeit, erhöhte Leberwerte (GPT-Wert) und Muskelsteifigkeit kommen häufig vor.[12] Mit Ausnahme von Mundtaubheit sind diese Nebenwirkungen für Neuroleptika gut bekannt. Die Mundtaubheit hängt mit den lokalanästhetischen Eigenschaften von Asenapin zusammen, was als wenig relevant eingestuft wird.[13] Asenapin bewirkt im Vergleich zu Olanzapin eine geringer ausgeprägte Gewichtszunahme und Veränderung metabolischer Parameter.[14]
Studien Bearbeiten
ARES und APOLLO Bearbeiten
Die Monotherapie-Studien bestanden aus zwei jeweils über 3 Wochen laufenden Studien (ARES-3A und ARES-3B). In diesen Studien wurde die Wirksamkeit von Asenapin mit einer Placebobehandlung bei Patienten mit akuten manischen oder gemischten Episoden bei Bipolar-I-Störung verglichen.[15][16]
Nach einer Therapiedauer von 3 Wochen konnten die Patienten an ARES-9 teilnehmen, einer über 9 Wochen laufenden Folgestudie, bei der die Patienten entweder Asenapin 2 x tgl. in einer Dosierung von 5 mg oder 10 mg oder 1 x tgl. Olanzapin in einer Dosierung von 5 bis 20 mg erhielten. Im Gegensatz zu den ARES-3A- und ARES-3B-Studien wurde bei ARES-9 die Nichtunterlegenheit der Wirksamkeitserhaltung von Asenapin gegenüber Olanzapin über bis zu 12 Wochen getestet.[5]
Und schließlich konnten die Patienten, die ARES-9 abschlossen, auch noch an der 40-wöchigen ARES-40-Verlängerungsstudie teilnehmen. Das Design von ARES-40 sah vor, die Langzeitsicherheit von Asenapin bis zu 52 Wochen lang zu überprüfen.[6]
Die Studien zur Kombinationstherapie umfassten eine 12-wöchige Behandlungsdauer, in der Asenapin plus Lithium oder Valproinsäure mit einem Placebo plus Lithium oder Valproinsäure verglichen wurde. Hierbei ging es um die Behandlung von Patienten mit akuten manischen oder gemischten Episoden bei Bipolar-I-Störung, die auf eine Behandlung mit Lithium oder Valproinsäure allein nicht vollständig ansprachen. Patienten, welche die APOLLO-12-Studie abschlossen, konnten danach an der 40-wöchigen Verlängerungsstudie APOLLO-40 teilnehmen. Das primäre Studienziel von APOLLO-40 bestand in der Charakterisierung der Langzeitsicherheit und Verträglichkeit von Asenapin für einen Zeitraum von bis zu 52 Wochen.[17]
Phase III (manische Phasen einer bipolaren Störung) Bearbeiten
Vor allem zwei randomisierte dreiwöchige Kurzzeitstudien mit Asenapin werden von der EMA bewertet. Sie sind placebokontrolliert und haben zudem einen Olanzapinarm (A7501004/NCT00159744[15] und A7501005/NCT00159796[16]). Außerdem wird Asenapin in einer randomisierten 12-wöchigen Studie zusätzlich zu Lithium oder Valproat geprüft (A7501008/NCT00145470) und in mehreren Nachbeobachtungen untersucht (neun Wochen: A7501006/NCT00143182[5], 40 Wochen: A7501009/NCT00145509, 40 Wochen: A7501007/NCT00159783[6])
In die beiden wesentlichen Kurzzeitstudien werden Patienten mit der DSM IV-Diagnose einer manischen oder gemischten Phase einer Bipolar-I-Störung eingeschlossen, die in einem gängigen Test mit dem die manische Symptomatik gemessen werden kann, der Young Mania Rating Scale (YMRS), mindestens 20 Punkte erzielen. Die YMRS prüft 11 items, maximal können 60 Punkte erreicht werden. Zu den Ausschlusskriterien der Studien gehört die Einnahme von Lithium, Valproat oder Carbamazepin bis kurz vor Studienbeginn. Asenapin wird in einer Dosis von 5 bis 10 mg zweimal täglich, Olanzapin in einer Tagesdosis von 5 bis 20 mg geprüft. Primär wird die Wirksamkeit mittels der Änderung des Gesamtpunkte-Werts der YMRS untersucht. In beiden Kurzzeitstudien verringert Asenapin den YMRS-Punktwert im Placebovergleich statistisch signifikant (Asenapin:-11,5;-10,8 Placebo: -7,8; -5,5 Olanzapin: -14,6; -12,6).
Pharmakologische Eigenschaften Bearbeiten
Wirkungsmechanismus Bearbeiten
Der genaue Wirkmechanismus ist, ebenso wie von anderen bei bipolarer Störung wirksamen Arzneimitteln, nicht vollständig geklärt. Asenapin wirkt im Gehirn an vielen verschiedenen Rezeptoren. Ein antagonistischer Effekt an D2- und 5-HT2A-Rezeptoren scheint im Vordergrund zu stehen.[7]
Aufnahme und Verteilung im Körper Bearbeiten
Asenapin weist nach oraler Einnahme nur eine sehr geringe Bioverfügbarkeit von weniger als 2 % auf und liegt daher als Sublingualtablette vor. Die Sublingualtablette wird unter die Zunge gelegt, bis sie sich vollständig aufgelöst hat. Die Tablette löst sich im Speichel innerhalb von Sekunden auf.[2]
Chemie Bearbeiten
Chemische Struktur und Isomerie Bearbeiten
Asenapin ist eine tetracyclische chemische Verbindung; sie besteht aus einem zentralen, siebengliedrigen Oxepan-Ring, an den zwei Benzol- und ein Pyrrolidin-Ring anelliert sind. Einer der beiden Benzolringe trägt ein Chloratom. Die Struktur von Asenapin unterscheidet sich von den Strukturen anderer atypischen Antipsychotika.
5-Chlor-2,3,3a,12b-tetrahydro-2-methyl-1H-dibenz[2,3:6,7]oxepino[4,5-c]pyrrol enthält zwei verschiedene Stereozentren am Pyrrolidinring. Folglich gibt von dieser Substanz vier Stereoisomere: Die (3aR,12bR)-Form, die dazu spiegelbildlicher (3aS,12bS)-Form sowie die (3aR,12bS)-Form und die (3aS,12bR)-Form. Der Arzneistoff Asenapin ist ein 1:1-Gemisch (Racemat) aus der (3aR,12bR)-Form und der (3aS,12bS)-Form.[18]
Synthese Bearbeiten
Asenapin wird in einer mehrstufigen Synthese nach van der Burg aus einem Diphenylether hergestellt.[19]
Handelspräparate Bearbeiten
Asenapin wurde von Organon entwickelt. Asenapin-haltige Fertigarzneimittel werden in der EU unter dem Handelsnamen Sycrest von Lundbeck und in den USA unter dem Namen Saphris von MSD vertrieben.
Hersteller sind Organon und Schering-Plough.
Siehe auch Bearbeiten
Weblinks Bearbeiten
Einzelnachweise Bearbeiten
- ↑ a b Datenblatt Asenapine maleate bei Sigma-Aldrich, abgerufen am 21. März 2011 (PDF).
- ↑ a b c EMA: Summary of Product Characteristics Asenapine/Sycrest 2010, (PDF; 330 kB)
- ↑ FDA: FDA Approves Saphris to Treat Schizophrenia and Bipolar Disorder, abgerufen am 7. November 2012.
- ↑ swissmedic.ch: Sycrest®, Sublingualtabletten (Asenapinum) ( vom 4. März 2016 im Internet Archive), abgerufen am 7. November 2012.
- ↑ a b c Mc Intyre RS et al.: Asenapine versus olanzapine in acute mania: a double-blind extension study. In: Bipolar Disorders 2009: 11: 815–826, PMID 19832806.
- ↑ a b c McIntyre RS et al.: J. Affect. Disord. 2010; 126: 358-65, PMID 20537396.
- ↑ a b Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ): Neue Arzneimittel: Sycrest® (Asenapin) (PDF; 297 kB) vom 12. Januar 2011.
- ↑ EMA: EPAR zu Asenapine/Sycrest 2010, S. 62 ff, S. 69.(PDF; 1,2 MB)
- ↑ McIntyre RS, Pharmacology and efficacy of asenapine for manic and mixed states in adults with bipolar disorder, Expert Rev. Neurother. 10(5), 645–649 (2010)
- ↑ Etzel Gysling: Asenapin. In: pharma-kritik. Band 35, Nr. 9, 6. Dezember 2013, doi:10.37667/pk.2013.914 (infomed.ch [abgerufen am 11. April 2021]).
- ↑ Brigitte M. Gensthaler, Sven Siebenand: Neu auf dem Markt: Asenapin, Bazedoxifen, Bilastin, Conestat alfa und Vernakalant. Pharmazeutische Zeitung, Ausgabe 01/2011.
- ↑ Sycrest: Zusammenfassung der Merkmale des Arzneimittels, August 2016.
- ↑ EMA: EPAR zu Asenapine/Sycrest 2010, S. 77, (PDF; 1,2 MB)
- ↑ EMA: EPAR zu Asenapine/Sycrest 2010, S. 85, (PDF; 1,2 MB)
- ↑ a b McIntyre RS et al.: Bipolar Disord. 2009; 11: 673-86, PMID 19839993.
- ↑ a b McIntyre RS et al.: J. Affect. Disord. 2010;122: 27–38, PMID 20096936.
- ↑ Calabrese JR, Stet L, Kothari H et al. 62. Kongress "Institute on Psychiatric Services" der American Psychiatric Association (APA). Poster. Oktober 2010, Boston, MA, USA.
- ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 137, ISBN 978-0-911910-00-1.
- ↑ Patentanmeldung DE2723209A1: Tetracyclische Pyridin- oder Pyrrolderivate. Angemeldet am 23. Mai 1977, veröffentlicht am 15. Dezember 1977, Anmelder: Akzo N.V., Erfinder: Willem Jacom Van der Burg.