Ammoniumhydrogencarbonat
Ammoniumhydrogencarbonat (auch Ammoniumbicarbonat, ABC-Trieb) ist ein Ammoniumsalz der Kohlensäure. Es ist Hauptbestandteil des Hirschhornsalzes.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 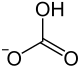
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumhydrogencarbonat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | NH4HCO3 | ||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver mit ammoniakartigem Geruch[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 79,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[3] | ||||||||||||||||||
| Dichte |
1,58 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt |
Zersetzung ab 60 °C[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−849 kJ·mol−1[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen Bearbeiten
In der Natur findet sich Ammoniumhydrogencarbonat als das Mineral Teschemacherit, sowie in Guanolagern an der Westküste Patagoniens und auf den Chincha-Inseln.[6]
Gewinnung und Darstellung Bearbeiten
Die Herstellung erfolgt durch Einleiten von Kohlenstoffdioxid in konzentrierte Ammoniaklösung bei 35 bis 40 °C. Das ausgefallene kristalline Ammoniumhydrogencarbonat wird abzentrifugiert und bei einer Temperatur von 40 °C getrocknet.
Eigenschaften Bearbeiten
Ammoniumhydrogencarbonat bildet farblose prismenförmige Kristalle[4], die in einem rhombischen Kristallgitter auftreten.[6] Das Salz löst sich sehr gut in Wasser. Die Löslichkeit steigt mit der Temperatur an.
| Löslichkeit von Ammoniumhydrogencarbonat in Wasser[7] | ||||||||||||
| Temperatur | in K | 273,2 | 283,2 | 293,2 | 303,2 | 313,2 | 323,2 | 333,2 | ||||
| in °C | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||||
| Löslichkeit | in Ma% | 10,6 | 13,9 | 17,8 | 22,1 | 26,8 | 31,6 | 37,2 | ||||
Der pH-Wert einer wässrigen Lösung (50 g/l bei 20 °C) beträgt ca. 8.[3] Schon bei Raumtemperatur kann ein langsamer Zerfall in Ammoniak, Kohlenstoffdioxid und Wasser beobachtet werden. Die Zerfallsgeschwindigkeit nimmt mit steigender Temperatur stark zu.[4]
Der Zerfall kann über die entsprechenden Dissoziationsdrücke quantifiziert werden.[7]
| Dissoziationsdruck von Ammoniumhydrogencarbonat[7] | ||||||||||||
| Temperatur | in K | 298,6 | 307,4 | 313,9 | 318,2 | 323,2 | 329,0 | 332,5 | ||||
| in °C | 25,45 | 34,25 | 40,75 | 45,05 | 50,05 | 55,85 | 59,35 | |||||
| Druck | in kPa | 7,85 | 16,26 | 26,79 | 37,06 | 52,65 | 82,11 | 108,64 | ||||
Verwendung Bearbeiten
Da es eine definierte Zusammensetzung hat, ist es als Backtriebmittel („ABC-Trieb“ / Backpulver) zur Herstellung von Weihnachtsgebäck wie Lebkuchen und Spekulatius in großtechnischen automatisierten Backanlagen besser geeignet als Hirschhornsalz. Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 503ii zugelassen und kommt mit dem Zusatz reinst in den Handel.
Diesem Backtriebmittel verdanken angeblich die ufo-förmigen Kuchenstücke „Amerikaner“ ihren Namen. Ursprünglich nannte man diese Kuchenstücke laut dieser umstrittenen Theorie „Ammoniakaner“. Dieses Wortungetüm soll ein Bäcker dann gegen „Amerikaner“ ausgetauscht haben (andere Theorien dazu unter Amerikaner (Gebäck)).
In der Volksrepublik China wurde Ammoniumhydrogencarbonat früher in großen Mengen als wichtigster Stickstoffdünger eingesetzt. Die Produktion begann 1958 und fand in über 1000 Kleinanlagen statt.[8] Inzwischen wurde es vor allem durch Harnstoff ersetzt, 2012 lag der Marktanteil aber noch bei 17 %.[9]
Einzelnachweise Bearbeiten
- ↑ Eintrag zu E 503: Ammonium carbonates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- ↑ Eintrag zu AMMONIUM BICARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- ↑ a b c d e f g h Eintrag zu Ammoniumhydrogencarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Ammoniumhydrogencarbonat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Oktober 2014.
- ↑ PAETEC Formelsammlung Ausgabe 2003, S. 116.
- ↑ a b Brockhaus ABC Chemie. F.A. Brockhaus Verlag, Leipzig 1971, S. 73.
- ↑ a b c K.-H. Zapp, K.-H. Wostbrock, M. Schäfer, K. Sato, H. Seiter, W. Zwick, R. Creutziger, H. Leiter: Ammonium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005. doi:10.1002/14356007.a02_243.
- ↑ Ching-Kwei Li, Rong-Yen Chen: Ammonium bicarbonate used as a nitrogen fertilizer in China. In: Fertilizer Research. Band 1, Nr. 3, 1980, S. 125–136, doi:10.1007/BF01053127.
- ↑ Yara Fertilizer Industry Handbook 2014 (Memento vom 17. Mai 2017 im Internet Archive), S. 25.
