Junctional Adhesion Molecule (JAM) („junktionales Adhäsionsmolekül“,[1] lat. iunction = „Verbindung“) heißen Proteine, die zu einer Untergruppe der Immunglobulin-Superfamilie[2] gehören. Sie bestehen aus 2 Immunglobulin-ähnlichen Domänen, einer Transmembrandomäne und einer kurzen zytoplasmatischen Domäne. Sie sind nur bei Wirbeltieren vorhanden.
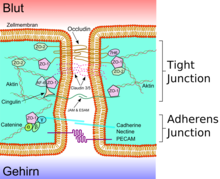
JAMs werden von einer Vielzahl verschiedener Zellen exprimiert. Man findet sie vornehmlich in Epithelzellen, Endothelzellen und Zellen des Immunsystems (Leukozyten), aber auch in Zellen des zentralen und peripheren Nervensystems, männlichen Keimzellen und Sertolizellen.
In Epithelzellen und Endothelzellen sind die Junctional Adhesion Molecules Bestandteil der Tight Junctions. Innerhalb des Zytoplasmas sind die JAMs mit dem Aktin-Zytoskelett verbunden.[3][4]
Familienmitglieder
BearbeitenBisher sind drei Junctional Adhesion Molecules mit etwa 300 bis 310 Aminosäuren bekannt. Zwei weitere Immunglobuline mit etwa 400 Aminosäuren und gleicher Funktion können hinzugezählt werden.
JAM-A
BearbeitenJAM-A (Gen-Name: F11R) war das erste Junctional Adhesion Molecule das entdeckt wurde. JAM-A wird im Wesentlichen in den Tight Junctions epithelialer und endothelialer Zellen exprimiert. Es spielt bei der Migration von Leukozyten eine Schlüsselrolle. Ebenso ist es in die durch Antikörper induzierte Thrombozytenaggregation involviert.[5]
JAM-B
BearbeitenJAM-B (auch CD322, Gen-Name: JAM2) spielt bei der Transmigration von Lymphozyten durch das Endothel eine wichtige Rolle. JAM-B wurde erstmals 2001 beschrieben und wird auf Endothelien und Lymphatischen Zellen exprimiert. Es besteht aus 298 Aminosäuren.[6][7]
JAM-C
BearbeitenJAM-C (Gen-Name: JAM3) ist das Dritte bisher bekannte Junctional Adhesion Molecule. Das für dieses Protein codierende Gen befindet sich beim Menschen auf Chromosom 11 Genlocus q25. JAM-C wird außer in Endothel- und Epithelzellen auch in Fibroblasten, Zellen der glatten Muskulatur, Spermatiden und peripheren Nervenzellen exprimiert.[8][9][10][11] AM-like
JAM-like (Gen-Name: AMICA1) hat ähnliche Funktion wie JAM-B und wird in blutbildenden und Leberzellen exprimiert.[12]
IGSF5
BearbeitenAuch IGSF5 fungiert in Tight Junctions, insbesondere möglicherweise in den Glomeruli der Nieren und im Dünndarm. Außerdem hat es Aufgaben bei der Zelladhäsion von Spermien.[13]
Literatur
Bearbeiten- W. H. Ouwehand: Cell surface interactions at the vascular wall. In: EBI (Hrsg.): reactome.org. 12. November 2007, doi:10.3180/REACT_12051.1 (reactome.org).
Weblinks
BearbeitenEinzelnachweise und Fußnoten
Bearbeiten- ↑ Anmerkung: Dieser Begriff ist in der deutschsprachigen Fachliteratur, im Gegensatz zu der englischsprachigen Bezeichnung, kaum gebräuchlich.
- ↑ K. Ebnet: Junctional Adhesion Molecules (JAMs): Cell Adhesion Receptors With Pleiotropic Functions in Cell Physiology and Development. In: Physiol Rev. Band 97, Nr. 4, 1. Okt 2017, S. 1529–1554. doi:10.1152/physrev.00004.2017. PMID 28931565.
- ↑ P. Florian: Restitution von Einzelzell-Läsionen im Kolonepithel. Dissertation. FU Berlin, 2002. urn:nbn:de:kobv:188-2002003079 (refubium.fu-berlin.de)
- ↑ G. Bazzoni: The JAM family of junctional adhesion molecules. In: Curr. Opin. Cell Biol. Band 15, Nr. 5, Oktober 2003, S. 525–530, PMID 14519386.
- ↑ U. P. Naik, K. Eckfeld: Junctional adhesion molecule 1 (JAM-1). In: J. Biol. Regul. Homeost. Agents. Band 17, Nr. 4, 2003, S. 341–347, PMID 15065765.
- ↑ M. Aurrand-Lions, C. Johnson-Leger, C. Lamagna, H. Ozaki, T. Kita, B. A. Imhof: Junctional adhesion molecules and interendothelial junctions. In: Cells Tissues Organs. Band 172, Nr. 3, 2002, S. 152–160, PMID 12476045.
- ↑ M. Aurrand-Lions, L. Duncan, C. Ballestrem, B. A. Imhof: JAM-2, a novel immunoglobulin superfamily molecule, expressed by endothelial and lymphatic cells. In: J. Biol. Chem. Band 276, Nr. 4, Januar 2001, S. 2733–2741, doi:10.1074/jbc.M005458200, PMID 11053409.
- ↑ A. P. Morris, A. Tawil, Z. Berkova, L. Wible, C. W. Smith, S. A. Cunningham: Junctional Adhesion Molecules (JAMs) are differentially expressed in fibroblasts and co-localize with ZO-1 to adherens-like junctions. In: Cell Commun. Adhes. Band 13, Nr. 4, 2006, S. 233–247, doi:10.1080/15419060600877978, PMID 16916751.
- ↑ T. Keiper, N. Al-Fakhri, E. Chavakis, et al.: The role of junctional adhesion molecule-C (JAM-C) in oxidized LDL-mediated leukocyte recruitment. In: FASEB J. Band 19, Nr. 14, Dezember 2005, S. 2078–2080, doi:10.1096/fj.05-4196fje, PMID 16195363.
- ↑ G. Gliki, K. Ebnet, M. Aurrand-Lions, B. A. Imhof, R. H. Adams: Spermatid differentiation requires the assembly of a cell polarity complex downstream of junctional adhesion molecule-C. In: Nature. Band 431, Nr. 7006, September 2004, S. 320–324, doi:10.1038/nature02877, PMID 15372036.
- ↑ C. Scheiermann, P. Meda, M. Aurrand-Lions, et al.: Expression and function of junctional adhesion molecule-C in myelinated peripheral nerves. In: Science. Band 318, Nr. 5855, November 2007, S. 1472–1475, doi:10.1126/science.1149276, PMID 18048693.
- ↑ C. Moog-Lutz, F. Cavé-Riant, F. C. Guibal, et al.: JAML, a novel protein with characteristics of a junctional adhesion molecule, is induced during differentiation of myeloid leukemia cells. In: Blood. Band 102, Nr. 9, November 2003, S. 3371–3378, doi:10.1182/blood-2002-11-3462, PMID 12869515.
- ↑ UniProt Q9NSI5