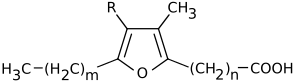
Furanfettsäuren (FFA, von engl. furan fatty acids), auch F-Säuren genannt, sind eine Gruppe von Fettsäuren, die einen Furanring enthalten. An einer Position des Furanringes befindet sich ein unverzweigter Carbonsäurerest, an einer anderen Position ein Alkylrest. Die natürlichen Furanfettsäuren sind zudem am Furanring einfach oder zweifach methylsubstituiert.[1] Sie sind in einer Vielzahl von Pflanzen- und Tierarten nachweisbar.
Carboxylsubstituierte F-Säuren bezeichnet man als Urofuransäuren. Urofuranfettsäuren sind Stoffwechselprodukte der Furanfettsäuren, die sich beispielsweise im menschlichen Harn (Namensgebung) nachweisen lassen.[2]
Vorkommen
BearbeitenFuranfettsäuren finden sich vor allem im Leberfett von Fischen, in Krebstieren und Hornkorallen. Daneben kommen sie auch in der Leber von Rindern und Ratten sowie im Humanblut vor; entweder in freier Form oder in Triglyceriden gebunden oder an Cholesterin verestert. In Fischen ist die Konzentration an Furanfettsäuren in der Leber nach Hungerperioden besonders hoch.
Furanfettsäuren können in einer Vielzahl von Organismen und Produkten, wie beispielsweise Butter oder Butterschmalz,[3] nachgewiesen werden. Man geht mittlerweile davon aus, dass diese Verbindungsklasse ubiquitär ist.[4][5]
Sämtliche Vorkommen von Furanfettsäuren in Tieren beruhen auf der Aufnahme und Akkumulation von Furanfettsäuren aus pflanzlichen Bestandteilen.[6] Im menschlichen Blut beträgt der Gesamtgehalt an Furanfettsäuren etwa 50 ng/ml. Pro Tag scheidet ein Mensch zwischen 0,5 und 3 mg an Urofuransäuren – dem Stoffwechselprodukt der Furansäuren – aus.[7][8][9] Tiere sind nicht in der Lage F-Säuren zu synthetisieren. Größere Mengen an Furanfettsäuren produzieren vor allem Algen, aber auch einige Pflanzen und Mikroorganismen. Diese dienen Fischen und Säugern als Nahrung und die so zugeführten Furanfettsäuren werden in Phospholipide und Cholesterinester eingebaut.[8]
Funktion und physiologische Wirkung
BearbeitenFuranfettsäuren sind reaktive Verbindungen. Durch Photooxidation,[10] Autoxidation[10][11][12] oder katalysiert durch Lipoxygenase-1[10][13][14] sind sie leicht oxidierbar. Unter Lichteinwirkung entsteht aus Furanfettsäuren in der Reaktion mit Singulett-Sauerstoff der Aromastoff 3-Methyl-2,4-nonandion (MND), der einen heuartigen Geruch aufweist und beispielsweise im Grünen Tee[15] enthalten ist.[16]
Furanfettsäuren sind sehr effektive Radikalfänger. Dabei entstehen Dioxoen-Fettsäuren, die selbst sehr instabil sind und mit Thiolen, wie beispielsweise Cystein oder Glutathion, Thioether bilden.[17] Als potente Antioxidantien fangen sie speziell Hydroxyl-Radikale ab.[18] Man vermutet daher, dass dies in verschiedenen biologischen Systemen ihre Hauptfunktion ist.[19] Sie hemmen außerdem die durch Singulett-Sauerstoff induzierte Hämolyse der Erythrozyten (Auflösung der roten Blutkörperchen).[20][21]
Pflanzen und Algen bilden mittels Biosynthese aus mehrfach ungesättigten Fettsäuren (PUFA, von engl. polyunsaturated fatty acids) die Furanfettsäuren. Diese dienen dabei offensichtlich dem Schutz vor freien Radikalen, die in diesen Organismen durch die Einwirkung von Sonnenlicht erzeugt werden.[22][23]
Vereinzelt wird spekuliert, dass die ursprünglich den Omega-3-Fettsäuren zugeschriebenen gesundheitsfördernden Eigenschaften möglicherweise nicht auf diese, sondern auf die ebenfalls im Fisch enthaltenen Furanfettsäuren zurückzuführen sein könnten.[24][25] Eine klinische Studie zeigt bei der Gabe von isolierten Omega-3-Fettsäuren, wie beispielsweise Eicosapentaensäure (EPA) oder Docosahexaensäure (DHA), an Patienten, die bereits einen Herzinfarkt hatten, bezüglich kardiovaskulären Effekten keinen signifikanten Unterschied gegenüber einem Placebo.[26]
Die genauen pathologischen Wirkungen der Furanfettsäuren sind noch nicht im Detail geklärt und Gegenstand aktueller Forschungsprojekte. Man vermutet neben der antioxidativen Wirkung auch antitumorale (gegen bösartige Tumoren) und antithrombotische (gegen Thrombose gerichtete) Effekte.[27] 2002 wurden xenohormonelle Eigenschaften für die beiden Furanfettsäuren 9,(12)-Oxy-10,13-dihydroxystearinsäure und 10,(13)-Oxy-9,12-dihydroxystearinsäure beobachtet. Bei In-vitro-Versuchen an MCF-7-Zellen (Brustkrebszellen mit Estrogenrezeptor) wurden mitogene Eigenschaften sowie eine Beeinflussung des Östrus festgestellt. Bei letzterem wurde der Übergang zum Metöstrus initiiert.[28][29] In vivo wurde an weiblichen Farbratten eine Reduzierung der Paarungswilligkeit nach der Gabe von Furanfettsäuren beobachtet.[30] Allerdings wurde weder eine estrogene noch eine anti-estrogene Aktivität nachgewiesen.[28][29][31] Bei Hühnern wurden keinerlei negative Effekte auf Nahrungsaufnahme, Fertilität, Ei-Gewicht, Schalenstärke der Eier und andere reproduktive Parameter nach der gezielten Gabe von Furanfettsäuren festgestellt.[31]
Entdeckung
BearbeitenFuranfettsäuren wurden erstmals 1966 von L. J. Morris und Kollegen als Bestandteil eines aus Samen von Exocarpos cupressiformis (eine Pflanze aus der Ordnung der Sandelholzartigen) gewonnenen Öls nachgewiesen.[32] Jahre später stellte man mit anderen Analysemethoden fest, dass das Öl von Exocarpos cupressiformis nicht die von Morris beschriebene Furanfettsäure 9,12-Epoxyoctadeca-9,11-diensäure enthält, sondern dass diese erst bei der Probenaufbereitung durch Oxidation von Hydroxyfettsäuren, bei der basenkatalysierten Umesterung für die von Morries und Kollegen verwendete Argentationschromatographie, entstanden ist.[33] 1974 wurden Furanfettsäuren von Robert L. Glass und Kollegen erstmals im Hecht (Esox lucius) mittels Gaschromatographie und nachgeschalteter Massenspektroskopie (GC-MS) identifiziert.[5][34]
Weiterführende Literatur
Bearbeiten- N. Hinrichsen: Synthese und Analytik von Furanfettsäuren. Dissertation, Universität Hamburg, 2009, ISBN 3-86853-028-2
- V. M. Dembitsky, T. Rezanka: Furan fatty acids of some brackish invertebrates from the Caspian sea. In: Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology 114, 1996, S. 317–320 doi:10.1016/0305-0491(96)00063-6
- M. R. Prinsep, J. W. Blunt, M. H. Munro: Isolation of the furan fatty acid, (8Z,11Z,14Z,17Z)-3,6-epoxyeicos-3,5,8,11,14,17-hexenoic acid from the New Zealand sponge Hymeniacidon hauraki In: J Nat Prod. 57, 1994, S. 1557–1559 doi:10.1021/np50113a014 PMID 7853004
- H. G. Wahl: Die Bedeutung von Furanfettsäuren als Inhaltsstoffe von Fischölpräparaten. In: GIT Labor-Fachzeitschrift 4, 1988, S. 368–372.
- K. Ishii, H. Okajima, Y. Okada, H. Watanabe: Studies on furan fatty acids of salmon roe phospholipids In: J Biochem. 103, 1988, S. 836–839 PMID 3182753
- G. Spiteller: Furanfettsäuren. In: Nachrichten aus Chemie, Technik und Laboratorium. 35, 1987, S. 1240–1243 doi:10.1002/nadc.19870351204
- C. H. Rahn u. a.: Synthesis of naturally occurring furan fatty acids. In: J Org Chem. 44, 1979, S. 3420–3424 doi:10.1021/jo01333a036
- R. L. Glass, T. P. Krick, D. M. Sand, C. H. Rahn, H. Schlenk: Furanoid fatty acids from fish lipids In: Lipids 10, 1975, S. 695–702 PMID 1196019
- R. Jónsdóttir, P. Hamaguchi, G. Ólafsdóttir, T. Wang: Antioxidants from Icelandic marine sources. (PDF-Datei; 429 kB), Mai 2010.
Einzelnachweise
Bearbeiten- ↑ S. Göckler: Metabolismus und genetische Toxizität von Furanfettsäuren, sowie deren Einfluss auf Zellmembranen in vitro. Dissertation, Universität Karlsruhe, 2009.
- ↑ D. M. Sand, H. Schlenk, H. Thoma, G. Spiteller: Catabolism of fish furan fatty acids to urofuran acids in the rat In: Biochim. Biophys. Acta 751, 1983, S. 455–461 PMID 6849955.
- ↑ H. Guth und W. Grosch: Furan fatty acids in butter and butter oil. In: Zeitschrift für Lebensmitteluntersuchung und -Forschung A 194, 1992, S. 360–362. doi:10.1007/BF01193220
- ↑ K. Hannemann u. a.: The common occurrence of furan fatty acids in plants. In: Lipids 24, 1989, S. 296–298. doi:10.1007/BF02535166 PMID 2755307.
- ↑ a b R. Pompizzi: Furanfettsäuren als Vorläufer von Aromastoffen. Dissertation, ETH Zürich, 1999.
- ↑ C. P. Gorst-Allman u. a.: Investigations of the origin of the furan fatty acids (F-acids). In: Lipids 23, 1988, S. 1032–1036. doi:10.1007/BF02535648 PMID 3237002.
- ↑ Gerhard Spiteller: Furanfettsäuren. In: Nachrichten aus Chemie, Technik und Laboratorium. Band 35, Nr. 12, 1987, S. 1240–1243, doi:10.1002/nadc.19870351204.
- ↑ a b c G. Spiteller: Furan fatty acids: Occurrence, synthesis, and reactions. Are furan fatty acids responsible for the cardioprotective effects of a fish diet? In: Lipids 40, 2005, S. 755–771. doi:10.1007/s11745-005-1438-5 PMID 16296395 (Review).
- ↑ Simon Göckler: Metabolismus und genetische Toxizität von Furanfettsäuren, sowie deren Einfluss auf Zellmembranen in vitro. Karlsruhe 2009, DNB 1013696247, S. 11, urn:nbn:de:swb:90-106030 (Dissertation, Universität Karlsruhe).
- ↑ a b c R. F. Boyer, D. Litts, J. Kostishak, R. C. Wijesundera, F. D. Gunstone: The action of lipoxygenase-1 on furan derivatives In: Chem. Phys. Lipids 25, 1979, S. 237–246 PMID 119581.
- ↑ K. Ishii u. a.: The Composition of Furan Fatty Acids in the Crayfish. In: Lipids. 23, 1988, S. 694–700. doi:10.1007/BF02535671
- ↑ G. Rosenblat u. a.: Inhibition of Bacterial Urease by Autoxidation of Furan C-18 Fatty Acid Methyl Ester Products. In: JAOCS 70, 1993, S. 501–505. doi:10.1007/BF02542584
- ↑ A. Batna und G. Spiteller: Oxidation of Furan Fatty Acids by Soybean Lipoxygenase-1 in the Presence of Linoleic Acid. In: Chem Phys Lipids. 70, 1994, S. 179–185, PMID 8033289.
- ↑ A. Batna und G. Spiteller: Effects of Soybean Lipoxygenase-1 on Phosphatidylcholines Containing Furan Fatty Acids. In: Lipids 29, 1994, S. 397–403, PMID 8090060.
- ↑ Werner Grosch: Das Geheimnis des Tee-Aromas. (PDF; 98 kB) In: teeverband.de. Deutsches Tee-Institut, 26. November 2010, archiviert vom (nicht mehr online verfügbar) am 18. April 2016; abgerufen am 20. Februar 2017.
- ↑ W. Grosch u. a.: Lehrbuch der Lebensmittelchemie Verlag Springer, 2007, ISBN 3-540-73201-2, S. 987. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Joachim Jandke, Jochen Schmidt, Gerhard Spiteller: Ueber das Verhalten von F-Saeuren bei Oxidation mit Lipoxydase in Anwesenheit von SH-haltigen Verbindungen. In: Liebigs Annalen der Chemie 1988, 1988, S. 29–34 doi:10.1002/jlac.198819880107
- ↑ G. Spiteller: Peroxyl radicals are essential reagents in the oxidation steps of the Maillard reaction leading to generation of advanced glycation end products. In: Ann N Y Acad Sci. 1126, 2008, S. 128–133, PMID 18448806.
- ↑ Y. Okada u. a.: Hydroxyl radical scavenging activity of naturally occurring furan fatty acids. In: Biol Pharm Bull. 19, 1996, S. 1607–1610, PMID 8996648.
- ↑ Y. Okada u. a.: Inhibitory effects of naturally occurring furan fatty acids on hemolysis of erythrocytes induced by singlet oxygen. In: Yakugaku Zasshi. 110, 1990, S. 665–672, PMID 2175788.
- ↑ D. C. White u. a.: Phospholipid furan fatty acids and ubiquinone-8: lipid biomarkers that may protect dehalococcoides strains from free radicals. In: Appl Environ Microbiol. 71, 2005, S. 8426–8433, PMID 16332831; PMC 1317454 (freier Volltext)
- ↑ G. Spiteller: The important role of lipid peroxidation processes in aging and age dependent diseases. In: Mol Biotechnol. 37, 2007, S. 5–12, PMID 17914157.
- ↑ G. G. Habermehl u. a. Naturstoffchemie. Verlag Springer, 2008, ISBN 3-540-73732-4, S. 566 eingeschränkte Vorschau in der Google-Buchsuche
- ↑ E. Bodderas: Das Märchen vom guten Fett. In: Die Welt vom 30. Mai 2010
- ↑ Elke Bodderas: Omega-3-Fette nicht gesünder als Schweineschmalz In: Welt Online, 31. Mai 2010. Abgerufen am 5. August 2012
- ↑ D. Kromhout, E. J. Giltay, J. M. Geleijnse: n-3 fatty acids and cardiovascular events after myocardial infarction In: N. Engl. J. Med. 363, 2010, S. 2015–2026 PMID 20929341.
- ↑ Deborah Pacetti, Francesca Alberti, Emanuele Boselli, Natale G. Frega: Characterisation of furan fatty acids in Adriatic fish. In: Food Chemistry. Band 122, Nr. 1, 2010, S. 209–215, doi:10.1016/j.foodchem.2010.02.059.
- ↑ a b B. Markaverich u. a.: Identification of an endocrine disrupting agent from corn with mitogenic activity. In: Biochem Biophys Res Commun. 291, 2002, S. 692–700, PMID 11855846
- ↑ a b B. Markaverich u. a.: A novel endocrine-disrupting agent in corn with mitogenic activity in human breast and prostatic cancer cells. In: Environ Health Perspect. 110, 2002, S. 169–177. PMID 11836146; PMC 1240732 (freier Volltext)
- ↑ T. Schettler: Corn and corn-derived products: Sources of endocrine disruptors. In: Environ Health Perspect. 111, 2003, A691. PMC 1241698 (freier Volltext) PMID 14527857.
- ↑ a b K. H. Wilhelms u. a.: Evaluation of Corn Furan Fatty Acid Putative Endocrine Disruptors on Reproductive Performance in Adult Female Chickens. In: Poultry Science. 85, 2006, S. 1795–1797, PMID 17012171.
- ↑ L. J. Morris u. a.: A Unique Furanoid Fatty Acid from Exocarpus Seed Oil. In: Tetrahedron Lett. 7, 1966, S. 4249–4253, doi:10.1016/S0040-4039(00)76045-X.
- ↑ F. D. Gunstone u. a.: Relative Enrichment of Furan-containing Fatty Acids in the Liver of Starving Cod. In: Chem Soc Chem Commun. 16, 1976, S. 630–631. doi:10.1039/C3976000630B
- ↑ R. L. Glass, T. P. Krick, und A. E. Eckhardt: New series of fatty acids in northern pike (esox lucius). In: Lipids, 9, 1974, S. 1004–1008, doi:10.1007/BF02533826.