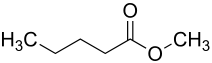
Valeriansäuremethylester (nach IUPAC Methylpentanoat, Methylvalerat) ist der Ester der Valeriansäure mit dem Alkohol Methanol. Die farblose, brennbare Flüssigkeit besitzt einen fruchtigen Geruch und wird daher als Aromastoff, auch für Lebensmittel,[6] eingesetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Valeriansäuremethylester | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H12O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,16 g·mol−1 | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (5 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,4003 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
BearbeitenMethylpentanoat kommt in ätherischen Ölen aus einigen Pflanzen vor.[3] So findet sich der Ester in geringen Mengen in reifen Ananas[7] und in der Jackfrucht.[8]
Darstellung und Gewinnung
BearbeitenDie technische Herstellung erfolgt durch säurekatalysierte Veresterung der Valeriansäure mit Methanol:[3]
Eigenschaften
BearbeitenValeriansäuremethylester ist eine farblose Flüssigkeit,[2] die unter Normaldruck bei 127 °C siedet.[9] Die molare Verdampfungsenthalpie am Siedepunkt beträgt 38,01 kJ·mol−1.[9] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in torr, T in °C) mit A = 6,97357, B = 1463,1497 und C = 220,647 im Temperaturbereich von 24,29 bis 165,23 °C.[10] Der Ester bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 27 °C.[2] Die Zündtemperatur beträgt 420 °C.[2] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
BearbeitenSchon seit dem 16. Jahrhundert wird der Ester als mildes Sedativum eingesetzt,[11] teils als Mischung Validolum mit Campher;[12] seit dem 19. Jahrhundert diente das Validol auch als Mittel gegen Seekrankheit.[13][14]
Heute wird der Hauptteil des produzierten Valeriansäuremethylesters als Duftstoff in der Parfümindustrie genutzt.
In der organischen Synthese wird die Verbindung in nucleophilen Substitutionen, in α-Alkylierungen, in Heterocyclensynthesen sowie der Kulinkovich-Reaktion verwendet.[3]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu METHYL VALERATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f g h i j k l m Eintrag zu Methylvalerat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu Pentanoate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. April 2018.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-364.
- ↑ Toxicometric Parameters of Industrial Toxic Chemicals Under Single Exposure. Izmerov, N.F., et al., Moscow, Centre of International Projects, GKNT, Pg. 88, 1982.
- ↑ Entscheidung 2002/113/EG der Kommission, S. 72, FL-Nr:09.18
- ↑ J. Schormüller: Handbuch der Lebensmittelchemie. Springer-Verlag, 1965
- ↑ A. Täufel, W. Ternes, L. Tunger, M. Zobel (Hrsg.): Lebensmittel-lexikon. Behr’s Verlag, 2005, ISBN 978-3-89947-165-6
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 1st Edition Elsevier 2008, ISBN 978-0-8155-1596-8, S. 333.
- ↑ Carl L. Yaws: The Yaws Handbook of Vapor Pressure – Antoine Coefficients, 2st Edition Elsevier 2015, ISBN 978-0-12-802999-2, S. 39, doi:10.1016/B978-0-12-802999-2.00004-0.
- ↑ Anm.: Viele Quellen unterscheiden nicht zwischen dem Baldriansäuremethylester und dem ähnlich wirkenden Baldriansäurementhylester, dem Ester der Valeriansäure mit Menthol.
- ↑ Pharmazeutische Zentralhalle für Deutschland. Theodor Steinkopff, 1914, Notizen: v.55 1914
- ↑ Archiv fuer Schiffs- und Tropen-Hygiene. 1906, Notizen: v.10 1906
- ↑ Excerpta Medica. C. Sallmann., 1904, Notizen: v.13 1903/1904

