Cyanobakterien
Die Cyanobakterien (wissenschaftlich Cyanobacteria, von altgriechisch κυανός kyanós, deutsch ‚blau‘, daher auch Blaugrünbakterien) bilden eine Abteilung (Phylum) der Domäne Bacteria. Sie zeichnen sich vor allen anderen Bakterien durch ihre Fähigkeit zur oxygenen Photosynthese aus. Früher wurden sie zu den Phycophyta (Algen) gerechnet und als Klasse Cyanophyceae („Blaualgen“) geführt. Der Name Cyanophyceae für eine einzige Klasse der Abteilung Cyanobacteria wird auch heute noch teilweise verwendet, etwa von AlgaeBase,[4] während andere Quellen innerhalb der Cyanobakterien verschiedene Teilklassen (wie Gloeobacteria und Oscillatoriophycideae) identifizieren.[5]
| Cyanobakterien | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
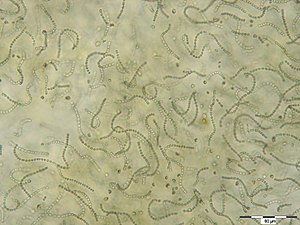
Zellfäden von Nostoc sp. | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Cyanobacteria | ||||||||||
| (ex Stanier 1974) Cavalier-Smith 2002[2] Woese et al. 1985[3] |
Einige Cyanobakterien enthalten neben anderen Photosynthese-Farbstoffen blaues Phycocyanin und ihre Farbe ist deshalb blaugrün – ein Umstand, dem die ganze Klade ihre verschiedenen Namen (Cyanobakterien, Blaugrünbakterien und Blaualgen) verdankt, darunter auch Mitglieder, die kein Phycocyanin enthalten und daher nicht blaugrün gefärbt sind.
Der Begriff „Algen“ bezieht sich im weiteren Sinn auf alle Wasserorganismen, die zur Photosynthese fähig sind, das trifft für die echten Cyanobakterien (Oxyphotobacteria, s. u.) wie auch für die eukaryotischen Grünalgen zu, worin die Bezeichnung „Blaualgen“ begründet ist. Cyanobakterien besitzen aber im Gegensatz zu Algen keinen echten Zellkern und sind somit als Prokaryoten nicht mit den im üblichen Sprachgebrauch als „Algen“ bezeichneten eukaryotischen Lebewesen (Grünalgen etc.) verwandt, sondern gehören zu den Bakterien – aus diesem Grund findet sich für das Taxon gelegentlich auch die etwas ungenaue Bezeichnung Cyanoprokaryoten (englisch cyanoprokaryotes).[6]
Cyanobakterien besiedeln vermutlich seit mehr als 3,5 Mrd. Jahren (Archaikum) die Erde und zählen zu den ältesten Lebensformen überhaupt.[7] Sie können die Richtung des Lichteinfalls wahrnehmen.[8] Nach der Endosymbiontentheorie sind die Cyanobakterien die Vorläufer der Chloroplasten: Chlorophyllfreie Vorläufer („Protozoen“) nahmen einst Cyanobakterien auf, die zu Endosymbionten und dann zu Chloroplasten wurden. Erst die Cyanobakterien machten also die Grünalgen grün.
Manchmal wird abweichend die Bezeichnung Cyanobakterien bzw. Cyanobacteria sensu lato (im weiteren Sinne) verwendet, indem einige verwandte Gruppen (wie die Melainabacteria und die Sericytochromatia)[9] miteinbezogen werden, die keine Photosynthese betreiben. Die eigentlichen, photosynthetisch aktiven Cyanobakterien werden dann als Oxyphotobacteria bezeichnet. Wegen ihrer hohen Diversität hat es auch Vorschläge gegeben, den Cyanobakterien (sensu lato) den Rang eines Superphylums (Überabteilung) zu verleihen (Cavalier-Smith 2006).[10]
Das National Center for Biotechnology Information (NCBI) verwendet jedoch den Terminus Cyanobacteria (Cyanobakterien) sensu stricto (im engeren Sinne) synonym zu Oxyphotobacteria,[5] und für die größere Verwandtschaftsgruppe die Bezeichnung Cyanobacteria/Melainabacteria group (Cyanobacteria/Melainabacteria-Gruppe).[1] Wo nicht anders vermerkt, wird im weiteren Verlauf dieser Sprachgebrauch übernommen.
Mehr als 2000 Arten von Cyanobakterien sind benannt, die in etliche Ordnungen eingeteilt werden; die Identifizierung von Klassen ist derzeit (Oktober 2021) noch nicht abgeschlossen (s. o.).
Merkmale und Vorkommen
BearbeitenCyanobakterien sind gramnegativ und ein- bis vielzellig. Bei mehrzelligen Cyanobakterien ist die Anordnung der Zellen entweder hintereinander in langen Fäden (Trichome genannt, zum Beispiel Anabaena und Oscillatoria), flächig (zum Beispiel Merismopedia) oder räumlich (zum Beispiel Pleurocapsa und Microcystis).
Cyanobakterien kommen als Kosmopoliten ubiquitär überwiegend in Süßwasser und Feuchtböden vor, aber auch in Meereswasser, auf Baumrinde und auf Gesteinsoberflächen.[11]
Photosynthese bei Oxyphotobacteria
BearbeitenDie Photosynthese der Cyanobakterien findet an bzw. in deren Thylakoidmembranen statt und läuft dort ähnlich wie in den Thylakoiden der Chloroplasten der eukaryotischen Algen, Moose, Farne und Samenpflanzen ab. Die Cyanobakterien nutzen für ihre Photosynthese nicht nur den Teil des Lichtspektrums, den auch die grünen Pflanzen verwenden, sondern sie haben neben Chlorophyll a einen zusätzlichen Antennenkomplex in Form von Phycobilisomen, in denen Phycobiline, nämlich Phycocyanin (blau) oder Phycoerythrin (rot), enthalten sind. Phycocyanin verleiht vielen Cyanobakterien ihre bläuliche Färbung, manchen (z. B. Planktothrix rubescens) verleiht Phycoerythrin eine rote Färbung. Da das Verhältnis der einzelnen Pigmente zueinander stark schwanken kann, erscheinen Cyanobakterien mitunter auch grün oder sogar schwarz (‚Tintenstriche‘). Phycobiline ermöglichen die Nutzung eines größeren Bereichs des Lichtspektrums (in der Grünlücke der Pflanzen, dem Wellenlängenbereich von ca. 500 bis 600 nm). Die Effizienz der Lichtverwertung ist bei Phycoerythrin sogar größer als beim Chlorophyll. Cyanobakterien können auf diese Weise ausgesprochene Schwachlichtbereiche erfolgreich besiedeln, wie z. B. die Unterseite von Flussgeröll oder tiefe Schichten in Seen.
Einige Cyanobakterien können auch eine anoxygene Photosynthese mit Schwefelwasserstoff (H2S) als Reduktionsmittel betreiben, sie bilden dabei also keinen Sauerstoff (O2).[12][13] Vor kurzem wurde ein Cyanobakterium entdeckt (UCYN-A, engl. unicellular N2-fixing cyanobacteria in „group A“), bei dem das Photosystem II fehlt.[14] Photosystem II enthält den wasserspaltenden Komplex, so dass dieses Cyanobakterium keine oxygene Photosynthese betreiben kann. Im Gegensatz zu oxygenen photoautotrophen Lebewesen fixiert dieser Stamm nicht Kohlenstoffdioxid (CO2) im Calvin-Benson-Bassham-Zyklus und ist photoheterotroph.[15] UCYN-A assimiliert aber elementaren Stickstoff (Distickstoff, N2), indem er ihn reduziert.
Nichtphotosynthetische Cyanobakterien
BearbeitenDurch Genomanalysen ribosomaler 16S-rRNA wurden Verwandte der Cyanobakterien identifiziert, die keine Photosynthese betreiben. Sie werden u. a. als Melainabacteria und Sericytochromatia in der Literatur geführt. Weitere Genomanalysen haben ergeben, dass in beiden Stämmen die Gene für die Photosynthese fehlen. Infolgedessen haben sie sich stammesgeschichtlich von den Vorläufern der jetzigen Oxyphotobacteria (d. h. der echten Cyanobakterien) abgespalten, bevor diese über horizontalen Gentransfer zur Photosynthese befähigt wurden. Dies deutet auch darauf hin, dass der gemeinsame Vorläufer aller Cyanobakterien selbst nicht photosynthetisch aktiv war (s. u.). Cyanobakterien, Melainabakteria, Sericytochromatia bilden zusammen mit einigen weiteren kleineren Gruppen eine als Cyanobacteria/Melainabacteria-Gruppe bezeichnete Klade (Verwandtschaftsgruppe) innerhalb der postulierten Terrabacteria.[16][17]
Ähnlich wie bei einigen Melainabakterien die Geißeln wieder verloren gingen, haben auch einige der echten Cyanobakterien (alias Oxyphotobacteria) die Fähigkeit zur Photosynthese verloren. Spirulina albida ist ein chlorophyllfreies, heterotrophes und saprotrophes Süßwasser-Cyanobakterium aus der Gattung Spirulina (nicht zu verwechseln mit Arthrospira, informell Spirulina genannt).[18][19][20][21] Spirulina albida kommt in Oberflächenfilmen vor.[22]
Stoffwechsel
BearbeitenViele Cyanobakterien können Stickstofffixierung betreiben: In Heterozysten wandeln sie molekularen Stickstoff (N2), abhängig vom pH-Wert, in Ammonium (NH4+) oder Ammoniak (NH3) um.
Cyanobakterien produzieren sehr unterschiedliche Toxine. Am bekanntesten sind die Microcystine bei Vertretern der Gattung Microcystis sowie Cylindrospermopsin.[23] Darüber hinaus konnte selbst in nicht näher verwandten Arten ein Neurotoxin, die giftige Aminosäure β-Methylamino-alanin (BMAA) nachgewiesen werden. Ausgehend von einem oft massenhaften Auftreten von Cyanobakterien bei sogenannten „Blaualgenblüten“ können beim Verzehr von Fischen oder Muscheln solche Toxine und auch BMAA über die Nahrungskette in den menschlichen Organismus gelangen und gelegentlich zu tödlichen Vergiftungen führen.
Cyanobakterien wurden und werden in der Naturstoffchemie sehr intensiv untersucht. Die bisher identifizierten Sekundärmetaboliten zeigen sehr unterschiedliche pharmakologische Wirkungen.[24]
Forscher der Carnegie Institution fanden Anfang 2006, dass im Yellowstone-Nationalpark lebende Cyanobakterien einen im Tag-Nacht-Rhythmus wechselnden Stoffwechsel betreiben: tagsüber Photosynthese und nachts Stickstofffixierung. Dies ist nach heutigem Wissensstand einmalig.
Systematik
BearbeitenZur Taxonomie der Cyanobakterien existieren derzeit mehrere Systeme.
Taxonomie nach LPSN (und NCBI)
BearbeitenDie Taxonomie-Datenbank des US-amerikanischen National Center for Biotechnology Information (NCBI) weist nur einem Teil der Cyanobakterien-Ordnungen eine der beiden Klassen zu. Bergey’s Manual of Systematic Bacteriology[3][25] verwendet anstelle von Ordnung und Familie die selbst erfundenen Ränge Subsection und Subgroup, welche statt mit Namen mit römischen Ziffern bezeichnet werden, da nicht alle gebräuchlichen Ordnungen und Familien nach dem Bacteriological Code gültig beschrieben wurden.
Die Taxonomie der Cyanobakterien wurde von Strunecký & Mareš 2022/2023 neu geordnet.[26] Diese Änderungen sind bereits in der List of Prokaryotic names with Standing in Nomenclature (LPSN) enthalten.[27]
Die folgende Taxonomie richtet sich nach der LPSN[27] mit einigen Anmerkungen bzgl. Abweichungen in der Taxonomie des National Center for Biotechnology Information (NCBI)[5], Stand: 26. Dezember 2023:
Klade Cyanobacteria/Melainabacteria-Gruppe [Cyanoprokaryota] (N)
- Phylum „Candidatus Margulisiibacteriota“ corrig. Anantharaman et al. 2016 (syn. Margulisbacteria, früher RIF30, RBX1/ZB3)[28][29][30][31]
- Phylum „Candidatus Saganiibacteriota“ corrig. Probst et al. 2017 (syn. Saganbacteria, früher WOR-1)[28][29][32][33]
- ohne Zuordnung zu einem Phylum – in der GTDB zum Phylum Cyanobacteriota
- Klasse „Candidatus Sericytochromatia“ Soo et al. 2017 (syn. Blackallbacteria, früher ML635J-21[34])[35][36]
- Phylum „Candidatus Melainabacteria“ Di Rienzi et al. 2013 (N) – in der LPSN zum Phylum Cyanobacteriota
- Phylum Cyanobacteriota Oren et al. 2022 (L)
- = Cyanobakterien s. l.
- Klasse „Ca. Melainabacteria“ Soo et al. 2014 (L) – in der NCBI-Taxonomie eigenes Phylum
- Klasse Cyanophyceae Schaffner 1909 (L) = Cyanobakterien s. s.
- = Klasse Oxyphotobacteria (ex Gibbons & Murray 1978) Murray 1988 (L)
- = photosynthetische Cyanobakterien
- Ordnung Acaryochloridales Strunecký & Mareš 2023
- Ordnung Chroococcales Schaffner 1922
- Ordnung Chroococcidiopsidales Komárek et al. 2014
- Gattung Chroococcidiopsis etc.
- Ordnung Coleofasciculales Strunecký & Mareš 2023
- Familie Coleofasciculaceae mit Gattung Coleofasciculus[37]
- Ordnung Desertifilalesv Strunecký & Mareš 2023
- Ordnung Geitlerinematales Strunecký & Mareš 2023
- Familie Geitlerinemataceae und Gattung Geitlerinema[38]
- Ordnung Gloeobacterales Cavalier-Smith 2002
- Gattung Gloeobacter etc.
- Ordnung Gloeomargaritales Moreira et al. 2017
- Gattunf Gloeomargarita etc.
- Ordnung Gomontiellales Strunecký & Mareš 2023
- Ordnung Leptolyngbyales Strunecký & Mareš 2023
- Ordnung Nodosilineales Strunecký & Mareš 2023
- Ordnung Nostocales Borzì 1914 mit früherer Ordnung Stigonematales
- Gattungen Anabaena, Aphanizomenon, Cylindrospermum, Cyanomargarita, Gloeotrichia, Halotia, Johannesbaptistia, Nostoc, Nodularia, Richelia, Rivularia, Stigonema, Trichormus etc.
- Ordnung Oculatellales Strunecký & Mareš 2023
- Ordnung Oscillatoriales Schaffner 1922
- Gattungen Lyngbya, Oscillatoria, Arthrospira (de. Bez. Spirulina), Cyanothece, Planktothrix, Phormidium, Oxynema, Coleofasciculus etc.
- Ordnung Pelonematales Skuja 1956
- Ordnung Pleurocapsales Geitler 1925
- Gattung Pleurocapsa etc.
- Ordnung Spirulinales Komárek et al. 2014
- Gattungen Lusitaniella, Spirulina (wiss. Name)
- Ordnung „Synechococcales“ Hoffmann et al. 2005
- Gattungen Acaryochloris, Cyanobium, Merismopedia, Parasynechococcus, Prochlorococcus, Prochloron, Prochlorothrix, Pseudanabaena, Synechococcus etc.
- Ordnung Thermostichales Komarek et al. 2020
- (L) – LPSN
- (N) – Taxonomie des NCBI
Die Margulisiibacteriota (Margulisbacteria), Saganiibacteriota (Saganbacteria) und Sericytochromatia werden in der LPSN keinem höheren Taxon zugeordnet,[31][33][36] in der Taxonomie des NCBI aber der Cyanobacteria/Melainabacteria-Gruppe unterstellt.[5]
- Eine Klade von Cyanobakterien mit α-Carboxysomen wird nach den in ihr enthaltenen (wichtigsten) Vertretern Synechococcus/Prochlorococcus/Cyanobium-Klade oder Alpha-Cyanobakterien (α-Cyanobacteria) genannt.[39]
- Eine weitere Klade von Cyanobakterien mit β-Carboxysomen, die u. a. Synechococcus enthält wird Beta-Cyanobakterien (β-Cyanobacteria) genannt.[40][41]
Taxonomie nach WoRMS
BearbeitenDie Taxonomie der World of Marine Species (WoRMS) kennt nur Salz-, Brack- und Süßwasserorganismen (rezent oder fossil). Es gibt nur die eine herkömmlich Klasse Cyanophyceae, die aber in Unterklassen unterteilt ist.
Taxonomie nach WoRMS (Stand 12. Oktober 2021):[42]
Abteilung (Phylum) Cyanobacteria mit der einzigen Klasse Cyanophyceae (alias Myxophyceae)
- Unterklasse Nostocophycideae
- Ordnung Nostocales
- Unterklasse Oscillatoriophycideae
- Ordnung Chroococcales (mit Familie Gloeobacteraceae)
- Ordnung Oscillatoriales
- Ordnung Spirulinales
- Unterklasse Synechococcophycideae
- Ordnung Pseudanabaenales
- Ordnung Synechococcales (Fam. Synechococcaceae inkl. Prochlorococcaceae)
- ohne Ordnungszuweisung: Acaryochloridaceae
- ohne Unterklassenzuweisung
- Ordnung Pleurocapsales
- Ordnung Stigonematales
- etliche Gattungen ohne jegliche weitere Zuordnung
Taxonomie nach Cavalier-Smith
BearbeitenThomas Cavalier-Smith nennt 6 Ordnungen, von denen er die Gloeobacterales (mit der einzigen Gattung Gloeobacter) in eine eigene Unterabteilung Gloeobacteria stellt und die andere Unterabteilung, die Phycobacteria, in die Klassen Chroobacteria (Ordnungen Chroococcales, Pleurocapsales, Oscillatoriales) und Hormogoneae (Nostocales, Stigonematales) aufteilt.[43]
Fossile Cyanobakterien
BearbeitenDie taxonomische Zugehörigkeit der Fossilien von Cyanobakterien wurde lange Zeit aufgrund des Fehlens besonders diagnostischer morphologischer Merkmale wiederholt in Frage gestellt. Seit einiger Zeit stehen jedoch besser erhaltene Fossilien von Cyanobakterien bis zurück zum Proterozoikum zur Verfügung, darunter die folgenden Gattungen:[7]
- Eoentophysalis aus der Belcher Supergroup (Entophysalidaceae, Alter ca. 2 Ga, d. h. 2 Milliarden Jahre; vgl. auch Eoentophysalis hutuoensis, Hebiancun-Formation, Paleoproterozoikum[44])
- Obruchevella, Gaoyuzhuang-Formation in China und Burgess Shale u. a., 1,5 Ga über Kambrium bis Devon[45][46][47]
- Eohyella (Fossilien endolithischer Cyanobakterien, ca. 0,8 Ga, aus verkieselten Ooiden der Eleonore Bay Group; vgl. Eohyella dichotoma.[48]).
Aufgrund der guten Erhaltung dieser Fossilien gibt es diagnostische morphologische Merkmale für die Kalibrierung der molekularen Uhr der Cyanobakterien.[7]
Neben diesen gibt es auch erhaltene Strukturen von Plastiden fossiler (eukaryontischer) Algen, die mit ihren Wirtszellen eine Koevolution durchliefen.[7]
Zwei eng-spiralige (en. tightly coiled) Cyanobakterien aus marinen mikrobiellen Matten (BPC1_4624, BPC2_4625) wurden in eine Gruppe mit der zuvor sequenzierten fest gewickelten Spirulina und nicht mit den beiden lose gewickelten sequenzierten Arthrospira-Vertretern in Verbindung gebracht. Das Fehlen der gewundenen Gestalt bei anderen, eng verwandten Cyanobakteriengruppen deutet auf eine unabhängige Entwicklung dieses Merkmals innerhalb dieser beiden Gruppen hin.[7]
Die ältesten indirekten Hinweise auf die Existenz von Cyanobakterien könnten Einschlüsse von 12C (C-12) in 2,5 Milliarden Jahre altem grönländischem Rubin sein, die 2021 entdeckt wurden. Im Gegensatz zum Isotop 14C, das in der Atmosphäre auf abiotische Weise entsteht, liegt bei dieser Ansammlung von 12C eine biologische Entstehung, vorzugsweise durch Cyanobakterien, nahe.[49]
Phylogenese
Bearbeitenstem Cyanobacteria = Cyanobacteria/Melainabacteria-Gruppe.
Neuere molekulare Analysen haben etwa die folgenden äußere Verwandtschaftsbeziehungen ergeben:[50][51][52][30][53]
| Cyanobacteria s. l. |
| ||||||||||||||||||||||||
| Cyanobacteria s. s. |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Anm.: [★] CgC = Crown group Cyanobacteria (bzw. Oxyphotobacteria)
Die sauerstofferzeugende (oxygene) Photosynthese ist ein abgeleitetes Merkmal der Cyanobakterien, die diese Fähigkeit neben vier weiteren Bakteriengruppen entwickelt haben – diese anderen sind Purpurbakterien, Grüne Nichtschwefelbakterien, Heliobakterien, Grüne Schwefelbakterien und die Acidobakterien[54] Sie nutzen das Sonnenlicht zur Photosynthese und setzten als Abfallprodukt Sauerstoff (O2) frei. Für ein ausführliches Chronogramm siehe Chronogramm der Cyanobakterien nach Fournier et al. (2021).[7]
Die Trennung der Linien von Melainabacteria und Cyanobacteria erfolgte vermutlich vor ca. 3,5 Milliarden Jahren.[7] Während dann offenbar die Melainabakterien Geißeln erwarben,[55][56][51] entwickelten die Cyanobakterien die Fähigkeit zur Photosynthese weiter.[56][16]
Bedeutung für die Atmosphäre
BearbeitenVor etwa 2,4 bis 2,5 Milliarden Jahren veränderten die sich im Wasser massenhaft verbreitenden Vorläufer der heutigen Cyanobakterien entscheidend die Lebensbedingungen auf der Erde. Die massenhafte Produktion von Sauerstoff (durch Vertreter der Crown group der Cyanobakterien[50]) bewirkte eine entscheidende Veränderung der bisher sauerstofflosen Atmosphäre in eine sauerstoffhaltige Atmosphäre (Große Sauerstoffkatastrophe, englisch Great Oxygenation Event, GOE).[57][58] Die Anfänge der sauerstoffproduzierenden Cyanobakterien liegen demnach gut 300 Millionen Jahre vor dem GOE[7][59] (Nachlauf-Theorie).
Für diese Verzögerung wird der Impakt von Material durch auf die frühe Erde einschlagende Asteroiden in der Zeit vor 4 bis 2,5 Milliarden Jahren verantwortlich gemacht, das damals den Sauerstoff gebunden und aus der Atmosphäre entfernt hat. In der Zeit vor dem eigentlichen GOE kam es zu so genannten „Whiffs“ – dem kurzzeitigen Anstieg des Sauerstoffgehalts in der Atmosphäre, so dass der Sauerstoffgehalt der Atmosphäre über einen gewissen Zeitraum wie ein Jo-Jo auf und abging.[60][61] Offenbar wurden diese Anstiege anfangs noch durch die Einschläge immer wieder unterbrochen (eine alternative Erklärung sieht jedoch eher einen durch Vulkanausbrüche verursachten Populationsanstieg mariner Mikroorganismen als Ursache der Whiffs). Als das kosmische Bombardement nachließ, reicherte sich die Atmosphäre mit Sauerstoff an und es kam zum GOE.[62][63]
Nach der Endosymbiontentheorie waren Vorfahren der heutigen Cyanobakterien die Vorläufer der Chloroplasten in grünen Pflanzen. Dafür spricht sowohl die übereinstimmende Zellanatomie als auch ein Satz übereinstimmender biochemischer Merkmale, welche die Cyanobakterien gleich wie die Chloroplasten von den Eigenschaften der Eukaryontenzellen unterscheiden.
Gewässerbelastung und Bedeutung für die Tierwelt
BearbeitenEine Massenvermehrung von Cyanobakterien kann die Wasserqualität stark vermindern und die Gewässernutzung deutlich einschränken. Die Bakterien produzieren eine Vielzahl von Sekundärmetaboliten, die als Allelochemikalien, Antibiotika, Hormone und Toxine wirken und z. B. Fische und Zooplankton schädigen können. Einige der Toxine gehören zu den stärksten natürlichen Giften und können auch für Menschen und Landtiere gesundheitsgefährdend sein. So können bei Badenden etwa allergische Hautreaktionen entstehen und auch Entzündungen. Schluckt man cyanobakterienhaltiges Wasser, kann es zudem Magen- und Darminfektionen geben.[64]
Im Jahr 2017 war im Tegeler See in Berlin, 2019 im Mandichosee bei Augsburg[65] die Konzentration des Cyanobakteriengifts Anatoxin A so hoch, dass Tiere daran starben.[66][67] Es handelte sich um Cyanobakterien der Gattung Tychonema, die auch mikroskopisch in den Seen nachgewiesen wurden.[68] Im Sommer 2020 starben 6 Hunde nach einem Bad im Neuenburgersee infolge vermuteter erhöhter 'Blaualgenkonzentration', sodass ein Badeverbot erlassen wurde.[69]
In Afrika verendeten innerhalb weniger Monate im Jahr 2020 mehrere hundert Elefanten an Cyanobakterien.[70]
In den USA erkranken seit den 1990er-Jahren gehäuft Vögel, Fische und Reptilien im Südosten der Vereinigten Staaten an einer tödlich verlaufenden neurologischen Erkrankung namens aviäre vakuoläre Myelinopathie. Dafür verantwortlich ist das Toxin Aetokthonotoxin. Für die Biosynthese dieses Toxins sind erhöhte Bromid-Konzentrationen in den Gewässern notwendig. Mit Bromid allein synthetisieren die Cyanobakterien allerdings noch keine großen Mengen des Nervengifts, sondern erst unter Stressfaktoren, wie einem Abfall der Wassertemperatur.[71][72]
Nach dem Absterben der Cyanobakterienmassen wird bei deren mikrobiellem Abbau Sauerstoff verbraucht. Dadurch wird die Sauerstoffkonzentration im Gewässer oft stark verringert, was zu einem Fischsterben führen kann.
Die Bedingungen für starke Vermehrung von Cyanobakterien sind vielfältig und nicht immer eindeutig zu klären. Hoher Phosphat- und evtl. Stickstoffgehalt im Wasser – verursacht beispielsweise durch ungeklärte Abwässer mit Waschmittelrückständen oder durch Tierausscheidungen – können in Verbindung mit höheren Wassertemperaturen die Entwicklung der Bakterien begünstigen.[73] Als Gegenmaßnahme wird z. B. in der Schweiz der Greifensee seit 2009 künstlich belüftet.
Siehe auch
Bearbeiten- Algenfarngewächse zur Symbiose mit stickstofffixierenden Cyanobacteria
- Stromatolithen – von Cyanobakterien gebildete Sedimentgesteine
Literatur
Bearbeiten- Thomas Börner: Die Toxine der Cyanobakterien: Neue bioaktive Verbindungen. In: Biologie in unserer Zeit. Band 31, Nummer 2, 2001, S. 108–115.
- Toxinbildende Cyanobakterien (Blaualgen) in bayerischen Gewässern – Massenentwicklungen, Gefährdungspotential, wasserwirtschaftlicher Bezug. Materialienband 125, Bayerisches Landesamt für Umwelt, Augsburg Dezember 2006, ISBN 3-940009-08-3.
Weblinks
Bearbeiten- Cyanobakterien: Problematik der Cyanobakterien aufgrund der Cyanotoxine, wikibooks
- Introduction to the Cyanobacteria (Einführung in die Cyanobakterien), University of California, Museum of Paleontology (UCMP), Berkeley (englisch)
- Empfehlungen des Umweltbundesamtes zum Schutz von Badenden, in: Bundesgesundheitsbl., Band 58, S. 908–920, 8. Juli 2015, doi:10.1007/s00103-015-2192-8 (PDF, 13 Seiten)
- Alger, Schwedisches Meteorologisches und Hydrografisches Institut (SMHI): aktuelle Daten und Satellitenbilder zur Algenblüte in der Ostsee (schwedisch), abgerufen am 12. Oktober 2021
- Joe Dramiga: Die oxygene Fotosynthese der Cyanobakterien ist ein abgeleitetes Merkmal, in: Die Sankore Schriften, auf: Spektrum.de SciLogs vom 7. Juni 2017
- Carly Casella: We Just Got Closer to Pinpointing a Major Moment in Earth's Evolutionary History, auf: sciencealert vom 4. Oktober 2021 (englisch)
- Oxygenic Photosynthesis and Living Lineages of Cyanobacteria Evolved in Archean Eon, Study Suggests, auf: sci-news vom 30. September 2021 (englisch)
- Elena Bernard: Ursprünge der Photosynthese datiert, auf: wissenschaft.de vom 29. September 2021
- What Are Cyanobacteria And What Are Its Types?, auf: TheBigger.com
- Overview of cyanobacteria, Biologie Uni Hamburg (Memento im WebArchiv vom 28. Januar 2020)
- Webserver for Cyanobacteria Research (Memento im WebArchiv vom 16. September 2019)
- CyanoBase, Kazusa DNA Research Institute (Memento im Webarchiv vom 21. Dezember 2012)
- SIB: Bacteria: Trichormus: two membranes (Gram-): Morphology typical of Trichormus variabilis – Zellen von Trichormus variabilis mit Spore, Interaktive Graphik von SwissBioPics
- Anna Manz: Cyanobakterien als Seefahrer – Phytoplankton-Vorfahren besiedelten das offene Meer mittels Chitin-Flößen. Auf: scinexx.de vom 17. Mai 2023. Quelle: doi:10.1073/pnas.2213271120.
Einzelnachweise
Bearbeiten- ↑ a b NCBI: Cyanobacteria/Melainabacteria group (clade); graphisch: Cyanobacteria/Melainabacteria group, auf: Lifemap, NCBI Version.
- ↑ LPSN: Phylum "Cyanobacteria" (ex Stanier 1974) Cavalier-Smith 2002 ( vom 27. März 2023 im Internet Archive).
- ↑ a b LPSN: Phylum "Cyanobacteria" Woese et al. 1985.
- ↑ AlgaeBase: Class Cyanophyceae Schaffner, 1909.
- ↑ a b c d NCBI (National Center for Biotechnology Information) Taxonomy Browser: Cyanobacteriota Oren et al. 2022 (phylum, syn. Cyanophycota, Cyanophyta, Oxyphotobacteria, "Cyanobacteria" (ex Stanier 1974) Cavalier-Smith 2002), graphisch: Cyanobacteria, auf: Lifemap, NCBI Version.
- ↑ Jiří Komárek, Jan Kaštovský, Jan Mareš, Jeffrey R. Johansen: Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach. In: Preslia, Band 86, S. 295–335, Dezember 2014; ResearchGate (englisch).
- ↑ a b c d e f g h i j G. P. Fournier, K. R. Moore, L. T. Rangel, J. G. Payette, L. Momper, T. Bosak: The Archean origin of oxygenic photosynthesis and extant cyanobacterial lineages, Band 288, Nr. 1959, 29. September 2021, doi:10.1098/rspb.2021.0675, PMID 34583585
- ↑ Nils Schuergers, Tchern Lenn, Ronald Kampmann, Markus V. Meissner, Tiago Esteves, Maja Temerinac-Ott, Jan G. Korvink, Alan R. Lowe, Conrad W. Mullineaux et al.: Cyanobacteria use micro-optics to sense light direction. In: eLife, Band=5, S. e12620, 9. Februar 2016; doi:10.7554/eLife.12620, PMC 4758948 (freier Volltext), PMID 26858197.
- ↑ LPSN: Phylum "Candidatus Melainabacteria" Di Rienzi et al. 2013
- ↑ LPSN: Superphylum "Cyanobacteria" Cavalier-Smith 2006
- ↑ Cyanobakterien im Kompaktlexikon der Biologie, abgerufen am 31. Januar 2017.
- ↑ Y. Cohen et al.: Sulphide-dependent anoxygenic photosynthesis in the cyanobacterium Oscillatoria limnetica. In: Nature, Band 257, 1975, S. 489–492.
- ↑ Etana Padan: Facultative anoxygenic photosynthesis in cyanobacteria. In: Annual Review of Plant Physiology. Band 30, 1979, S. 27–40.
- ↑ J. P. Zehr et al.: Globally distributed uncultivated oceanic N2-fixing cyanobacteria lack oxygenic photosystem II. In: Science, Band 322 (5904), 2008, S. 1110–1112. PMID 19008448, doi:10.1126/science.1165340
- ↑ E. F. DeLong: Interesting things come in small packages. In: Genome Biology. Band 11, Nr. 5, 2010, S. 118, doi:10.1186/gb-2010-11-5-118
- ↑ a b Rochelle M. Soo, et al.: On the origins of oxygenic photosynthesis and aerobic respiration in Cyanobacteria. In: Science. Band 355, Nr. 6332, 31. März 2017, S. 1436–1440, doi:10.1126/science.aal3794, PMID 28360330 (englisch).
- ↑ Robert E. Blankenship: How Cyanobacteria went green. In: Science. Band 355, Nr. 6332, 31. März 2017, S. 1372–1373, doi:10.1126/science.aam9365, PMID 28360281 (englisch).
- ↑ Spirulina albida - Overview - Encyclopedia of Life. In: Encyclopedia of Life. (englisch).
- ↑ World Register of Marine Species (WoRMS): Spirulina albida Kolkwitz, 1909 (Kontrollkästchen 'marine only' deaktivieren)
- ↑ Ernst Georg Pringsheim: Selected papers. Institute of Microbiology, Rutgers, State University; [distributed by the Rutgers University Press], 1963 (englisch).
- ↑ Albert Balows, Hans G. Trüper, Martin Dworkin, Wim Harder, Karl-Heinz Schleifer: The Prokaryotes: A Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications. Springer Science & Business Media, 2013, ISBN 978-1-4757-2191-1 (englisch).
- ↑ Bacteriological Reviews. American Society for Microbiology (ASM), 1949 (englisch).
- ↑ M.G. Hinojosa, D. Gutiérrez-Praena, A.I. Prieto, R. Guzmán-Guillén, A. Jos: Neurotoxicity induced by microcystins and cylindrospermopsin: A review. In: Science of The Total Environment. Band 668, Juni 2019, S. 547–565, doi:10.1016/j.scitotenv.2019.02.426 (englisch).
- ↑ B. Falch: Was steckt in Cyanobakterien? In: Pharmazie in unserer Zeit. Band 25, Nr. 6, 1996, S. 311–321, doi:10.1002/pauz.19960250608
- ↑ George M. Garrity (Hrsg.): Bergey’s Manual of Systematic Bacteriology. 2. Auflage. Band 1: The Archaea and the deeply branching and phototrophic Bacteria. Springer, New York 2001. Zitiert nach J.P. Euzéby: List of Prokaryotic names with standing in Nomenclature (LPSN) ( vom 28. November 2008 im Internet Archive).
- ↑ Otakar Strunecký, Anna Pavlovna Ivanova, Jan Mareš: An updated classification of cyanobacterial orders and families based on phylogenomic and polyphasic analysis. In: Journal of Phycology, Band 59, Nr. 1, Februar 2023, S. 12–51; doi:10.1111/jpy.13304, PMID 36443823, ResearchGate, Epub 28. November 2022 (englisch).
- ↑ a b LPSN: Phylum Cyanobacteriota Oren et al. 2022.
- ↑ a b c d Cindy J. Castelle, Jillian F. Banfield: Major New Microbial Groups Expand Diversity and Alter our Understanding of the Tree of Life. In: Cell Perspective, Band 172, Nr. 6, S. 1181–1197, 8. März 2018; doi:10.1016/j.cell.2018.02.016; insbes. Tbl. S1 (englisch).
- ↑ a b c d Patricia Tamez-Guerra, Jesús O. Zuñiga-Sanchez, Alonso A. Orozco-Flores, Jose A. Valadez-Lira, Cristina Rodriguez-Padilla, Rosa O. Cañizares-Villanueva, Ricardo Gomez-Flores: Prevalence of Proteobacteria and Armatimonadetes phyla in a Photobioreactor under Carbon- and Nitrogen-Free Production Process. In: Fermentation Technology, Band 6, Nr. 2, 2. Mai 2017; doi:10.4172/2167-7972.1000142 (englisch).
- ↑ a b c d e f
Paula B. Matheus Carnevali, Frederik Schulz, Cindy J. Castelle, Rose S. Kantor, Patrick M. Shih, Itai Sharon, Joanne M. Santini, Matthew R. Olm, Yuki Amano, Brian C. Thomas, Karthik Anantharaman, David Burstein, Eric D. Becraft, Ramunas Stepanauskas, Tanja Woyke, Jillian F. Banfield: Hydrogen-based metabolism as an ancestral trait inlineages sibling to the Cyanobacteria. In: Nature Communications, Band 10, Nr. 1, Dezember 2019; doi:10.1038/s41467-018-08246-y, ResearchGate:330682681 (englisch). Siehe insbes. Fig. 1. Dazu:
- Paula B. Matheus Carnevali: Behind the Paper: Margulisbacteria and Saganbacteria, the newly uncovered siblings of Cyanobacteria In: Springer Nature: Research Communities, 28. Januar 2019.
- ↑ a b LPSN: Phylum "Candidatus Margulisiibacteriota" und Phylum "Candidatus Margulisbacteria".
- ↑ a b Qiyun Zhu, Uyen Mai, Rob Knight et al.: Phylogenomics of 10,575 genomes reveals evolutionary proximity between domains Bacteria and Archaea. In: Nature Communications, Band 10, Nr. 5477, 2. Dezember 2019; doi:10.1038/s41467-019-13443-4 (englisch). Siehe insbes. Fig. 1.
- ↑ a b LPSN: Phylum "Candidatus Saganiibacteriota" und Phylum "Candidatus Saganbacteria".
- ↑ a b Marie-Eve Monchamp, Piet Spaak, Francesco Pomati: Long Term Diversity and Distribution of Non-photosynthetic Cyanobacteria in Peri-Alpine Lakes. In: Frontiers in Microbiology, Band 9, Nr. 3344, 14. Januar 2019; doi:10.3389/fmicb.2018.03344, PMC 6340189 (freier Volltext), PMID 30692982 (englisch).
- ↑ NCBI Taxonomy Browser: Candidatus Blackallbacteria, Details: Candidatus Blackallbacteria Probst et al. 2018 (phylum).
- ↑ a b LPSN: Class "Candidatus Sericytochromatia".
- ↑ LPSN: Family Coleofasciculaceae Komárek et al. 2014. Aufgerufen am 19. Oktober 2023.
- ↑ LPSN: Family Geitlerinemataceae Strunecký and Mareš 2023. Aufgerufen am 19. Oktober 2023.
- ↑ Linda Oberleitner: Exploring transport processes across the symbiotic interface of amoebal host and early-stage photosynthetic organelle in Paulinella chromatophora. Dissertation zur Erlangung des Doktorgrades der Mathematisch-Naturwissenschaftlichen Fakultät der Heinrich-Heine-Universität Düsseldorf, Dezember 2020.
- ↑ Lynne Whitehead, Benedict M. Long, G. Dean Price, Murray R. Badger: Comparing the in Vivo Function of α-Carboxysomes and β-Carboxysomes in Two Model Cyanobacteria. In: Plant Physiol., Band 165, Nr. 1, Mai 2014, S. 398–411.; doi:10.1104/pp.114.237941, PMC 4012598 (freier Volltext), PMID 24642960, Epub 18. März 2014.
- ↑ Manuel Sommer, Fei Cai, Matthew Melnicki, Cheryl A. Kerfeld: β-Carboxysome bioinformatics: identification and evolution of new bacterial microcompartment protein gene classes and core locus constraints. In: J Exp Bot., Band 68, Nr. 14, 22. Juni 2017, S. 3841–3855; doi:10.1093/jxb/erx115, PMC 5853843 (freier Volltext), PMID 28419380, Epub 17. April 2017.
- ↑ WoRMS: Cyanobacteria (Kontrollkästchen ‚marine only‘ und ggf. ‚extant only‘ deaktivieren).
- ↑ T. Cavalier-Smith: The neomuran origin of archaebacteria, the negibacterial root of the universal tree and bacterial megaclassification. In: Int J Syst Evol Microbiol. Band 52, Teil 1, Januar 2002, S. 7–76. doi:10.1099/00207713-52-1-7, PMID 11837318.
- ↑ Leiming Yin, Fanwei Meng, Fanfan Kong, Changtai Niu: Microfossils from the Paleoproterozoic Hutuo Group, Shanxi, North China: Early evidence for eukaryotic metabolism. In: Precambrian Research. 342. Jahrgang, Nr. 105650, 2020, doi:10.1016/j.precamres.2020.105650, bibcode:2020PreR..342j5650Y (englisch).
- ↑ C. Mankiewicz: Obruchevella and Other Microfossils in the Burgess Shale: Preservation and Affinity. In: Journal of Paleontology. 66. Jahrgang, Nr. 5, 1992, S. 717–729, doi:10.1017/s0022336000020758 (englisch).
- ↑ S. Xueliang: Obruchevella from the early Cambrian Meishucun Stage of the Meishucun section, Jinning, Yunnan, China. In: Geological Magazine. 121. Jahrgang, Nr. 3, 2009, S. 179–183, doi:10.1017/S0016756800028235 (englisch).
- ↑ Vibhuti Rai, Veeru Kant Singh: Discovery of Obruchevella Reitlinger, 1948 from the Late Paleoproterozoic Lower Vindhyan Succession and its Significance. In: Journal of the Paleontological Society of India. 49. Jahrgang, 2004 (englisch, academia.edu). (Record of Obruchevella from the Mesoproterozoic sediments of India)
- ↑ Marine Endolithic Cyanobacteria - 3 (Hyella)
- ↑ Michelle Starr: For The First Time Ever, Evidence of Ancient Life Was Discovered Inside a Ruby, auf: sciencealert vom 22. Oktober 2021
- ↑ a b Alexander Pinevich, Svetlana Averina: New life for old discovery: amazing story about how bacterial predation on Chlorella resolved a paradox of dark cyanobacteria and gave the key to early history of oxygenic photosynthesis and aerobic respiration. In: Protistology, Band 15, Nr. 3, S. 107–126, 13. August 2021; doi:10.21685/1680-0826-2021-15-3-2, PDF (englisch). Siehe insbes. Fig. 1. Anm.: dark cyanobacteria = non-photosynthetic cyanobacteria s. l. = melainabacteria.
- ↑ a b Rochelle M. Soo, Ben J. Woodcroft, Donovan H. Parks, Gene W. Tyson, Philip Hugenholtz: Back from the dead; the curious tale of the predatory cyanobacterium Vampirovibrio chlorellavorus. In: PeerJ, Band 3, 21. Mai 2015, e968, doi:10.7717/peerj.968, PMID 26038723, PMC 4451040 (freier Volltext) (englisch). Siehe insbes. Fig. 1.
- ↑ Karthik Anantharaman, Christopher T. Brown, et al.: Thousands of microbial genomes shed light on interconnected biogeochemical processes in an aquifer system. In: Nature Communications, 2016; doi: 10.1038/ncomms13219, ResearchGate (englisch).
- ↑ Christian Rinke, Patrick Schwientek, Philip Hugenholtz, Tanja Woyke et al.: Insights into the phylogeny and coding potential of microbial dark matter. In: Nature, Band 499, 2013, S. 431–437; doi:10.1038/nature12352 (englisch).
- ↑ Joe Dramiga: Die oxygene Fotosynthese der Cyanobakterien ist ein abgeleitetes Merkmal, in: Die Sankore Schriften, auf: Spektrum.de SciLogs vom 7. Juni 2017.
Die fünf photosynthetisch aktiven Bakteriengruppen werden nicht ganz korrekt als „Familien“ bezeichnet, was nicht taxonomisch verstanden werden darf. - ↑ P. M. Shih, J. Hemp, L. M. Ward, N. J. Matzke, W. W. Fischer: Crown group Oxyphotobacteria postdate the rise of oxygen. In: Geobiology. 15. Jahrgang, Nr. 1, 15. Januar 2017, S. 19–29, doi:10.1111/gbi.12200, PMID 27392323 (englisch). Epub 8. Juli 2016.
- ↑ a b Sara C. Di Rienzi, Itai Sharon, Kelly C. Wrighton, Omry Koren, Laura A. Hug, Brian C. Thomas, Julia K. Goodrich, Jordana T. Bell, Timothy D. Spector, Jillian F. Banfield, R. E. Ley: The human gut and groundwater harbor non-photosynthetic bacteria belonging to a new candidate phylum sibling to Cyanobacteria. In: eLife. 2. Jahrgang, 1. Oktober 2013, S. e01102, doi:10.7554/eLife.01102, PMID 24137540, PMC 3787301 (freier Volltext) – (englisch, elifesciences.org).
- ↑ Heinrich D. Holland: The oxygenation of the atmosphere and oceans. In: Philosophical Transactions of the Royal Society B. Band 361, 19. Mai 2006, S. 903–915, doi:10.1098/rstb.2006.1838.
- ↑ John M. Olson: Photosynthesis in the archean era. In: Photosynthesis Research. Band 88, Nr. 2, 2006, S. 109–117, doi:10.1007/s11120-006-9040-5, PMID 16453059.
- ↑ Elena Bernard: Ursprünge der Photosynthese datiert, auf: wissenschaft.de vom 29. September 2021
- ↑
Ashley P. Gumsley, Kevin R. Chamberlain, Wouter Bleeker, Ulf Söderlund, Michiel O. de Kock, Emilie R. Larsson, Andrey Bekker: Timing and tempo of the Great Oxidation Event. In: PNAS, Band 114, Nr. 8, Februar 2017; doi:10.1073/pnas.1608824114 (englisch). Dazu:
Stephanie Pappas: Earth Nearly Lost All Oxygen And Could Have Suffocated 2.3 Billion Years Ago. Auf: sciencealert vom 9. April 2021. Quelle: LiveScience. - ↑ Ariel D. Anbar, Yun Duan, Timothy W. Lyons, Gail L. Arnold, Brian Kendall, Robert A. Creaser, Alan J. Kaufman, Gwyneth W. Gordon, Clinton Scott, Jessica Garvin, Roger Buick: A Whiff of Oxygen Before the Great Oxidation Event? In: Science, Band 317, Nr. 5846, S. 1903–1906, 28. September 2007; doi:10.1126/science.1140325 (englisch).
- ↑ Martin Vieweg: Wie kosmische Bomben die Atmosphäre prägten, auf: wissenschaft.de vom 22. Oktober 2021;
Michelle Starr: Asteroids May Have Stolen The Oxygen From Earth's Ancient Atmosphere, auf: sciencealert vom 21. Oktober 2021 - ↑ Aanchal Nigam: Volcanic Eruptions Caused First 'whiffs' Of Oxygen In Earth's Atmosphere: Study, auf: republicworld.com (Indien) vom 27. August 2021 (letzte Aktualisierung);
2.5-Billion-Year-Old Rocks Reveal Volcanic Eruptions Spurred First “Whiffs” of Oxygen in Earth’s Atmosphere, auf: SciTechDaily vom 6. November 2021. - ↑ Gefahr durch Blaualgen in Badeseen SWR.de. Abgerufen am 17. November 2019.
- ↑ Gönül Frey: Toter Hund: Es war tatsächlich die Giftalge. Lechstaustufe 23: Bei einem von drei verendeten Tieren ist die Todesursache eindeutig nachgewiesen. In: Augsburger Allgemeine. 23. August 2019, S. 29. Online.
- ↑ Neuartige Blaualge im Tegeler See tötete drei Hunde Morgenpost.de. Abgerufen am 27. Juli 2018.
- ↑ So kann man sich vor Blaualgen schützen tagesspiegel.de. Abgerufen am 27. Juli 2018.
- ↑ Jutta Fastner, Camilla Beulker, Britta Geiser, Anja Hoffmann, Roswitha Kröger, Kinga Teske, Judith Hoppe, Lars Mundhenk, Hartmud Neurath, Daniel Sagebiel, Ingrid Chorus: Fatal Neurotoxicosis in Dogs Associated with Tychoplanktic, Anatoxin-a Producing Tychonema sp. in Mesotrophic Lake Tegel, Berlin. In: Toxins. 2018, 10, 60; doi:10.3390/toxins10020060 (englisch).
- ↑ Cyanobakterien im See vermutet – Neuenburg schliesst mehrere Badestrände. srf.ch. Abgerufen am 31. Juli 2020.
- ↑ Cyanobakterien töteten Elefanten. In: Schweizer Bauer. 22. September 2020, abgerufen am 26. April 2021 (deutsch).
- ↑ Was vergiftet Amerikas Seeadler? In: FAZ. Abgerufen am 26. April 2021.
- ↑ Steffen Breinlinger, Tabitha J. Phillips, Brigette N. Haram, Jan Mareš, José A. Martínez Yerena: Hunting the eagle killer: A cyanobacterial neurotoxin causes vacuolar myelinopathy. In: Science. Band 371, Nr. 6536, 26. März 2021, doi:10.1126/science.aax9050, PMID 33766860 (englisch).
- ↑ Toxinbildende Cyanobakterien (Blaualgen) in bayerischen Gewässern – Massenentwicklungen, Gefährdungspotential, wasserwirtschaftlicher Bezug. Materialienband 125, Bayerisches Landesamt für Umwelt, Augsburg Dezember 2006, ISBN 3-940009-08-3.