Photo-Leucin
Photo-Leucin ist ein synthetisches Derivat der Aminosäure Leucin. Es trägt eine Diazirin-Gruppe, die im Vergleich zu Leucin eine Methylgruppe ersetzt. Es wird in der Biochemie zur Photoaffinitätsmarkierung verwendet.[2][3] Hierfür wird in der Regel das dem natürlich vorkommenden L-Leucin entsprechende isomerenreine L-Photo-Leucin verwendet.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
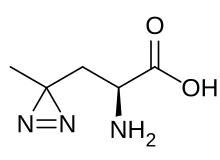
| |||||||||||||
| Abbildung von L-Photo-Leucin | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Photo-Leucin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C5H9N3O2 | ||||||||||||
| Kurzbeschreibung |
weißes bis gelbbraunes Pulver[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 143,14 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Löslichkeit |
löslich in Wasser: 10 g·l−1 (25 °C)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Eigenschaften Bearbeiten
Die Diazirin-Gruppe bildet bei UV-Bestrahlung Carbene, die unspezifisch mit Molekülen in der direkten Umgebung reagieren. Dadurch können Protein-Protein-Interaktionen bestimmt werden, da durch die Reaktion der Diazirin-Gruppe mit einem bindenden Protein eine kovalente Vernetzung dieser beiden Moleküle erfolgt. Die Vernetzung der beiden Proteine kann anschließend zur Reinigung und zum Nachweis verwendet werden, da zumindest einer der Bindungspartner bekannt ist und so z. B. mit einer Affinitätschromatographie oder einer Immunpräzipitation gereinigt und mit einer Immunfärbung nachgewiesen wird. Vorteile von Photo-Leucin ist die geringe Größe der reaktiven Gruppe, wodurch tendenziell weniger Protein-Protein-Interaktionen gestört werden sowie die Steuerbarkeit des Vernetzungszeitraums. Ein Nachteil ist die unselektive Reaktion mit einem Atom im benachbarten Molekül, die zu einem Verlust der biologischen Aktivität des gebundenen Moleküls führen kann. Da Leucin gehäuft in β-Faltblättern und β-Schleifen vorkommt, können gezielt daran bindende Proteine identifiziert werden.[4]
Einzelnachweise Bearbeiten
- ↑ a b c d Datenblatt L-Photo-Leucin bei lifetechnologies.com, abgerufen am 19. April 2015.
- ↑ M. Suchanek, A. Radzikowska, C. Thiele: Photo-leucine and photo-methionine allow identification of protein-protein interactions in living cells. In: Nature methods. Band 2, Nummer 4, April 2005, S. 261–267, doi:10.1038/nmeth752, PMID 15782218.
- ↑ A. L. MacKinnon, J. L. Garrison, R. S. Hegde, J. Taunton: Photo-leucine incorporation reveals the target of a cyclodepsipeptide inhibitor of cotranslational translocation. In: Journal of the American Chemical Society. Band 129, Nummer 47, November 2007, S. 14560–14561, doi:10.1021/ja076250y, PMID 17983236, PMC 2574519 (freier Volltext).
- ↑ C. Iacobucci, S. Reale, F. De Angelis: Photoactivable amino acid bioisosteres and mass spectrometry: snapshots of in vivo 3D protein structures. In: ChemBioChem. Band 14, Nummer 2, Januar 2013, S. 181–183, doi:10.1002/cbic.201200742, PMID 23280986.