N-Methyl-N-nitrosoharnstoff
N-Methyl-N-nitrosoharnstoff ist ein instabiles N-Nitrosoderivat des Harnstoffs, welches zur Gruppe der Nitrosoharnstoffe gehört.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
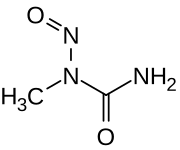
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N-Methyl-N-nitrosoharnstoff | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H5N3O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 103,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,58 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
14,4 g·l−1 in Wasser (24 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung und Gewinnung Bearbeiten
Die Darstellung der Verbindung erfolgt aus Harnstoff, Methylamin und Natriumnitrit.[3][1] Zunächst wird in einer Substitutionsreaktion N-Methylharnstoff gewonnen. Die Zielverbindung ergibt sich durch eine anschließende saure Nitrosierung.
Eigenschaften Bearbeiten
N-Methyl-N-nitrosoharnstoff ist ein kristalliner Feststoff, der zur spontanen explosiven Zersetzung neigt. Diese kann schon bei der Lagerung der Verbindung bei Raumtemperatur auftreten.[1] Die Zersetzung erfolgt als selbstbeschleunigende Reaktion.[4] Eine DSC-Messung zeigt ab 90 °C eine exotherme Zersetzung mit einer Wärmetönung von −1192 J·g−1 bzw. −122,9 kJ·mol−1.[5] Der Kontakt mit Alkalihydroxiden, Dichlormethan oder die Reibung mit Metallspateln können die Zersetzung ebenfalls auslösen. Als Zersetzungsprodukte wurden Methylisocyanat, Stickstoff und Wasser gefunden. Bei einer langsamen Zersetzung entsteht das Trimerisierungsprodukt N,N,N-Trimethylcyanursäure.[1][6]
Verwendung Bearbeiten
Die Verbindung kann zur Herstellung von Diazomethan verwendet werden.[7][1] Wegen der Instabilität der Verbindung werden heute allerdings andere Ausgangsverbindungen wie N-Methyl-N-nitroso-p-toluolsulfonamid bevorzugt, die außerdem nicht karzinogen sind.[1]
Einzelnachweise Bearbeiten
- ↑ a b c d e f g Lutz Roth, Ursula Weller-Schäferbarthold: Gefährliche Chemische Reaktionen. 69. Ergänzungslieferung, ecomed-Verlag 2013.
- ↑ a b c d e Eintrag zu N-Methyl-N-nitrosoharnstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. März 2018. (JavaScript erforderlich)
- ↑ F. Arndt: Nitrosomethylurea In: Organic Syntheses. 15, 1935, S. 48, doi:10.15227/orgsyn.015.0048; Coll. Vol. 2, 1943, S. 461 (PDF).
- ↑ F. Brogli, P. Grimm, M. Meyer, H. Zubler: Gefahren selbstbeschleunigender Reaktionen. In: Swiss Chem. 3, 1981, 3a.
- ↑ Ando, T.; Fujimoto, Y.; Morisaki, S.: Analysis of differential scanning calorimetric data for reactive chemicals in J. Hazard. Mat. 28 (1991) 251–280, doi:10.1016/0304-3894(91)87079-H.
- ↑ D.L. Muck: A study of the mechanism of the thermal and base induced conversion of N-nitroso-N-alkylamine derivatives to diazoalkanes, Dissertation University of Florida 1965, pdf.
- ↑ F. Arndt: Diazomethan In: Organic Syntheses. 15, 1935, S. 3, doi:10.15227/orgsyn.015.0003; Coll. Vol. 2, 1943, S. 165 (PDF).


