Magnetresonanztomographie
Die Magnetresonanztomographie, abgekürzt MRT oder MR (als Tomographie von altgriechisch τομή tome, deutsch ‚Schnitt‘ und γράφειν graphein, deutsch ‚schreiben‘), ist ein bildgebendes Verfahren, das vor allem in der medizinischen Diagnostik zur Darstellung von Struktur und Funktion der Gewebe und Organe im Körper eingesetzt wird. Es basiert physikalisch auf den Prinzipien der Kernspinresonanz (englisch nuclear magnetic resonance, NMR), insbesondere der Feldgradienten-NMR, und wird daher auch als Kernspintomographie bezeichnet (umgangssprachlich gelegentlich zu Kernspin verkürzt). Die ebenfalls zu findende Abkürzung MRI stammt von der englischen Bezeichnung magnetic resonance imaging.
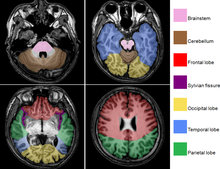




Mit der MRT können Schnittbilder des menschlichen (oder tierischen) Körpers erzeugt werden, die eine Beurteilung der Organe und vieler krankhafter Organveränderungen erlauben. Sie basiert auf – in einem Magnetresonanztomographiesystem (Kurzform: Kernspintomograph, MRT-Gerät) erzeugten – sehr starken Magnetfeldern sowie magnetischen Wechselfeldern im Radiofrequenzbereich, mit denen bestimmte Atomkerne (meist die Wasserstoffkerne/Protonen) im Körper resonant angeregt werden, wodurch in einem Empfängerstromkreis ein elektrisches Signal induziert wird. Da somit das zu beobachtende Objekt „selbst strahlt“, unterliegt die MRT nicht dem physikalischen Gesetz zum Auflösungsvermögen optischer Instrumente, nach dem die Wellenlänge der verwendeten Strahlung umso kleiner sein muss, je höher die geforderte Auflösung ist. In der MRT können mit Wellenlängen im Meterbereich (energiearme Radiowellen) Objektpunkte im Submillimeterbereich aufgelöst werden. Die Helligkeit unterschiedlicher Gewebetypen im Bild wird durch deren Relaxationszeiten und den Gehalt von Wasserstoff-Atomen (Protonendichte) bestimmt.[2] Welcher dieser Parameter den Bildkontrast dominiert, wird durch die Wahl der Pulssequenz beeinflusst.
Im Gerät wird keine belastende Röntgenstrahlung oder andere ionisierende Strahlung erzeugt oder genutzt. Allerdings sind die Wirkungen der magnetischen Wechselfelder auf lebendes Gewebe nicht vollständig erforscht.
Verfahren und Systeme Bearbeiten
Zahlreiche spezielle MRT-Verfahren wurden entwickelt, um außer Lage und Form der Organe auch Informationen über ihre Mikrostruktur und Funktion (besonders ihre Durchblutung) darstellen zu können, zum Beispiel:
- die Echtzeit-MRT zur filmischen Darstellung bewegter Gelenke oder Organe (z. B. Herz),
- die Magnetresonanzangiographie (MRA) zur Darstellung der Gefäße,
- die craniale Magnet-Resonanz-Tomographie zur Darstellung der Durchblutung im Gehirn,[1]
- die funktionelle Magnetresonanztomographie (fMRT oder fMRI) des Gehirns,
- die Perfusions-MRT zur Untersuchung der Gewebedurchblutung,
- die Diffusions- bzw. Diffusions-Tensor-Bildgebung (DTI) für eine virtuelle Rekonstruktion von Nervenfaserverbindungen,
- die MR-Elastographie.
Nach der Bauform unterscheidet man geschlossene MRT-Systeme mit kurzem oder langem Tunnel und offene MRT-Systeme (oMRT) mit C-Arm oder seitlich geöffnetem Tunnel. Geschlossene Tunnelsysteme liefern vergleichsweise bessere Bilddaten, offene MRT-Systeme ermöglichen dagegen den Zugang zum Patienten unter MRT-Kontrolle.
Ein weiteres Unterscheidungskriterium ist die Art der Magnetfelderzeugung. Für schwache magnetische Felder bis ca. 0,5 Tesla Flussdichte werden Permanentmagnete oder konventionelle Elektromagnete verwendet, für stärkere Felder dagegen supraleitende Magnetspulen.
Historische Entwicklung Bearbeiten
Die 1945/46 sowohl von Felix Bloch als auch von Edward M. Purcell beschriebene spezifische magnetische Resonanz von Atomkernen mit magnetischem Dipolmoment war die Grundlage für das seit den 1950er Jahren auch in der Medizin verwendete Verfahren der Magnetresonanzspektroskopie.[3] Die Magnetresonanztomographie wurde als bildgebende Methode von Paul C. Lauterbur im September 1971 erfunden; er veröffentlichte die Theorie zur Bildgebung im März 1973.[4][5] Die Hauptparameter, die zum Bildkontrast beitragen (Unterschiede in den Relaxationszeiten von Geweben), waren bereits gut 20 Jahre vorher von Erik Odeblad beschrieben worden.[6]
Lauterbur hatte zwei grundlegende Ideen, die eine Bildgebung auf der Grundlage der Kernspinresonanz erst möglich machten. Erstens gelang es ihm mit Feldgradienten-NMR, d. h. mit der Einführung von magnetischen Gradientenfeldern in das konventionelle NMR-Experiment, die NMR-Signale bestimmten räumlichen Bereichen einer ausgedehnten Probe zuzuordnen (Ortskodierung). Zweitens schlug er ein Verfahren vor, bei dem durch Rotation des ortskodierenden Magnetfeldgradienten in aufeinanderfolgenden Experimenten unterschiedliche Ortskodierungen (Projektionen) des Untersuchungsobjektes erzielt wurden, aus denen anschließend mit Hilfe der gefilterten Rückprojektion (englisch filtered backprojection) ein Abbild des Untersuchungsobjektes errechnet werden konnte. Sein 1973 publiziertes Ergebnis zeigt eine zweidimensionale Abbildung von zwei mit normalem Wasser gefüllten Röhrchen in einer Umgebung aus schwerem Wasser.
Für eine praktische Nutzung dieser Entdeckung waren auch spezielle apparative Neuerungen erforderlich. Die Firma Bruker in Karlsruhe hatte Anfang der 1960er Jahre in einer Gruppe um die Physiker Bertold Knüttel und Manfred Holz „quarzgesteuerte“ NMR-Impulsspektrometer[7] entwickelt, die z. B. von Peter Mansfield für grundlegende Experimente benutzt werden konnten. Mansfield entwickelte dann ab 1974 mathematische Verfahren, um die Signale schnell in Bildinformationen zu wandeln, sowie Techniken zur schichtselektiven Anregung. Weiterhin führte er 1977 die Verwendung extrem schneller Umschaltung der Gradienten ein (EPI = Echo Planar Imaging).[8] Dadurch wurde eine Bildgewinnung in deutlich unter einer Sekunde möglich („Schnappschuss-Technik“), die jedoch bis heute mit Abstrichen in der Bildqualität erkauft werden muss. Mansfield ist auch die Einführung magnetisch abgeschirmter Gradientenspulen zu verdanken. In seinen letzten aktiven Jahren suchte er nach Lösungen, um die erhebliche Lärmbelastung für die Patienten durch die extrem schnelle Gradientenumschaltung zu reduzieren.
Weitere für die breite klinische Nutzung der Magnetresonanztomographie (MRT) wichtige Beiträge stammen aus deutschen Forschungslaboren. In Freiburg entwickelten Jürgen Hennig und Mitarbeiter zu Anfang der 1980er Jahre eine Variante der Spin-Echo MRT, die heute unter den Abkürzungen RARE (Rapid Acquisition with Relaxation Enhancement)[9], FSE (Fast Spin Echo) oder TSE (Turbo Spin Echo) bekannt ist. Sie findet wegen ihrer Sensitivität in Bezug auf pathologische Gewebestrukturen und ihrer messtechnischen Effizienz allgemeine Verwendung. 1985 gelang Axel Haase, Jens Frahm und Dieter Matthaei in Göttingen mit der Erfindung des Schnellbild-Verfahrens FLASH[10] ein grundsätzlicher Durchbruch in der MRT. Die FLASH-Technik reduzierte die damaligen Messzeiten um bis zu zwei Größenordnungen (Faktor 100) ohne substanzielle Verluste an Bildqualität. Das Verfahren ermöglicht zudem ununterbrochene, sequentielle Messungen im dynamischen Gleichgewicht sowie völlig neue klinische Untersuchungen wie beispielsweise Aufnahmen aus dem Bauchraum bei angehaltenem Atem, dynamische Aufnahmen von mit dem EKG synchronisierten Herzfilmen, dreidimensionale Aufnahmen komplexer anatomischer Strukturen, Gefäßdarstellungen mit der MR-Angiographie und heute auch funktionelle Kartierungen des Cortex mit besonders hoher Auflösung. Damit war ab Mitte der 1980er Jahre der Weg frei für eine breite, vor allem klinische Anwendung der MRT in der medizinischen Diagnostik.
Umstritten ist der Beitrag von Raymond Damadian, der 1974 ein US-Patent zur Anwendung der NMR für die Krebsdiagnostik anmeldete[11] und 1976 damit ein Malignom bei einer Maus darstellen konnte. 1977 erstellte Damadian dann ein Kernspinbild eines menschlichen Thorax im Querschnitt.[12] Das Patent beschrieb zwar keine Methode zur Bildgebung, sondern nur eine Punktmessung, dennoch erstritt Damadian mit einem anderen Patent (Mehrschicht-Mehrwinkel-Messungen z. B. für MRT-Untersuchungen der Wirbelsäule) über 100 Millionen US-Dollar von den verschiedenen Herstellern von Magnetresonanztomographen. Sein ursprünglicher NMR-Scanner, der keine Bilder erzeugte, wurde klinisch nie eingesetzt, und auch seine damit angeblich gefundene Krebsnachweismethode ist nicht frei von Zweifeln. Sie beruht auf Differenzen in den NMR-Relaxationszeiten von gesundem Gewebe und Tumor-Gewebe. Diese von Damadian bereits 1971 publizierte Beobachtung (mittels der Magnetresonanzspektroskopie) wurde zwar grundsätzlich bestätigt, musste allerdings später dahin gehend relativiert werden, dass die Unterschiede nicht durchgehend zutreffen. Abweichende Relaxationszeiten des Gewebes sind weder notwendig noch hinreichend für das Vorhandensein von Tumorgewebe beim Probanden. Damadian wurde bei der Verleihung des Nobelpreises für die bildgebende Kernspinresonanz 2003 nicht berücksichtigt,[13] wogegen er öffentlich heftig protestierte.
Physik Bearbeiten
Kurzfassung Bearbeiten
Dieser Abschnitt beschreibt das Prinzip der MRT stark vereinfacht und nicht vollständig. Für eine präzisere Beschreibung siehe die nächsten Abschnitte.
Das Verfahren beruht darauf, dass die Atomkerne im untersuchten Gewebe durch eine Kombination von statischen und hochfrequenten magnetischen Feldern gezielt phasensynchron zu einer bestimmten Bewegung angeregt werden und dann ein messbares Signal in Form einer Wechselspannung abgeben, bis die Bewegung abgeklungen ist. Diese Bewegung heißt Larmorpräzession und ist mechanisch analog an einem Spielzeugkreisel zu beobachten, wenn seine Drehachse nicht senkrecht steht, sondern um die Senkrechte herum eine Präzession vollführt (s. Abb. rechts). Sowohl zur Anregung als auch zur Beobachtung des Signals ist eine Resonanzbedingung zu erfüllen, mit deren Hilfe es mittels inhomogener statischer Magnetfelder möglich ist, den Ort der präzedierenden Kerne zu ermitteln.
Einige Atomkerne (wie etwa die Wasserstoffkerne) in den Molekülen des zu untersuchenden Gewebes besitzen einen Eigendrehimpuls (Kernspin) und sind dadurch magnetisch. Diese Kerne erzeugen nach dem Anlegen eines starken statischen Magnetfeldes eine kleine longitudinale Magnetisierung in Richtung des statischen Feldes (Paramagnetismus). Durch ein kurzzeitig angelegtes zusätzliches hochfrequentes Wechselfeld im Radiofrequenzbereich lässt sich diese Magnetisierung aus der Richtung des statischen Feldes auslenken (kippen), also teilweise oder ganz (Sättigung) in eine transversale Magnetisierung umwandeln. Die transversale Magnetisierung beginnt sofort um die Feldrichtung des statischen Magnetfeldes zu präzedieren, d. h. die Magnetisierungsrichtung rotiert (siehe Abbildung zur Präzession). Diese Präzessionsbewegung der Gewebemagnetisierung induziert wie die Rotation des Magneten im Dynamo in einer Spule (Empfängerstromkreis) eine elektrische Spannung und kann damit nachgewiesen werden. Ihre Amplitude ist proportional zur transversalen Magnetisierung.
Nach Abschalten des hochfrequenten Wechselfeldes nimmt die transversale Magnetisierung (wieder) ab, die Spins richten sich also wieder parallel zum statischen Magnetfeld aus. Für diese sogenannte Relaxation benötigen sie eine charakteristische Abklingzeit. Diese ist von der chemischen Verbindung und der molekularen Umgebung abhängig, in der sich der präzedierende Wasserstoffkern befindet. Daher unterscheiden sich die verschiedenen Gewebearten charakteristisch in ihrem Signal, was zu verschiedenen Signalstärken (Helligkeiten) im resultierenden Bild führt.
Grundlagen Bearbeiten
Die physikalische Grundlage der Magnetresonanztomographie (MRT) bildet die Kernspinresonanz (engl. nuclear magnetic resonance, NMR). Hier nutzt man die Tatsache, dass die Atomkerne von Wasserstoff (Protonen) einen Eigendrehimpuls (Spin) und damit verknüpft ein magnetisches Dipolmoment besitzen. Auch manche anderen Atomkerne haben Spin und erhalten dadurch ein magnetisches Moment. (Ein Atomkern kann vom Standpunkt der klassischen Physik aus vereinfacht als ein Kugelkreisel mit einem Drehimpuls und einem magnetischen Dipolmoment angesehen werden, wobei die Ursache seines Drehimpulses klassisch jedoch nicht korrekt beschrieben werden kann.)
Wird ein solcher Kern in ein statisches magnetisches Feld gebracht, so ist seine Energie am niedrigsten, wenn das magnetische Dipolmoment zum Feld parallel ausgerichtet ist. Auf alle anderen Atomkerne wirkt ein Drehmoment, das die Richtung des magnetischen Moments in die Richtung des Magnetfeldes zu drehen versucht. Wegen des Eigendrehimpulses des Atomkerns und der Drehimpulserhaltung resultiert daraus die Präzessionsbewegung, d. h. die Drehimpulsorientierung des Kerns dreht sich ohne Änderung des Anstellwinkels um die Richtung des angelegten Magnetfeldes.
Durch die thermische Energie der Kerne bei normalen Temperaturen sind die Dipolmomente fast vollständig zufällig (isotrop) ausgerichtet; es gibt nur einen sehr kleinen Überschuss von Atomkernen (entsprechend der Boltzmann-Verteilung), deren Dipolmomente in Richtung des statischen Magnetfeldes ausgerichtet sind. Nur dieser geringe Überschuss bewirkt die außen messbare Magnetisierung in Richtung des äußeren statischen Feldes (die Longitudinalmagnetisierung in Longitudinalrichtung).[14]
Die Präzessionsbewegung der Kernspins erfolgt mit der Larmorfrequenz. Sie hängt von der Stärke des äußeren Magnetfeldes und vom betrachteten Kern ab, für Protonen bei 1 Tesla ist sie 42,58 MHz, also im UKW-Radiowellenbereich. Ein hochfrequentes Zusatzfeld, das orthogonal zum statischen Magnetfeld , also in der Transversalebene, schwingt und dessen Frequenz mit der Larmorfrequenz in Resonanz ist, lenkt alle Kerne phasensynchron aus ihrer aktuellen Lage zum statischen Feld aus. Die makroskopische Magnetisierung wird aus der Richtung des statischen Feldes gekippt, es entsteht eine Transversalmagnetisierung, die bei richtiger Einwirkungsdauer des Wechselfelds maximal gerade gleich der ursprünglichen Longitudinalmagnetisierung sein kann (Sättigung).
In einer Messspule wird durch die rotierende Transversalmagnetisierung eine Wechselspannung induziert. Ihre Frequenz ist die Larmorfrequenz, die bei einem statischen Gradientenfeld vom Ort abhängt, ihre Amplitude gibt die Stärke der Transversalmagnetisierung an, die ihrerseits von der genauen Folge (Sequenz) von Pulsen, vom Ort und vom Gewebetyp abhängig ist.
Das Ziel der MR-Tomographie ist die Erzeugung von Schichtbildern (beliebiger Orientierung) der räumlichen Verteilung der Transversalmagnetisierung .
Spin-Gitter-Relaxation (Längsrelaxation T1) Bearbeiten
Ist durch ein magnetisches Wechselfeld der richtigen Frequenz, Stärke und Dauer die Magnetisierung so aus der Longitudinalrichtung (z-Richtung) gekippt worden, dass sie in der xy-Ebene präzediert, hat die longitudinale Magnetisierung zunächst den Wert Null. Stellt man dann das Wechselfeld ab, beginnt sich der Gleichgewichtszustand mit ausschließlich longitudinaler Magnetisierung, also geringerer Energie, wieder aufzubauen. Ursache dieser Spin-Gitter-Relaxation ist die Einwirkung fluktuierender Störfelder auf die Momente der einzelnen Kerne, die durch benachbarte Atome hervorgerufen werden, die ihrerseits im thermischen Gleichgewicht mit der weiteren Umgebung stehen, die aus historischen Gründen als „Gitter“ bezeichnet wird. D. h., die Magnetisierung richtet sich wieder entlang des statischen Feldes aus, die Energie geht von den Kernen über die Atome ins Gitter. Diese Ausrichtung erfolgt exponentiell:
- ,
wobei die Stärke der Magnetisierung in Richtung von im Gleichgewichtszustand ist. Die Konstante gibt an, in welchem Zustand außerhalb des Gleichgewichts sich das System zu Beginn des Relaxationsprozesses befindet (z. B. : Sättigung, : Inversion). Die Zeit, bis die z-Komponente ca. 63 % ihres Ausgangswertes wieder erreicht hat, nennt man Spin-Gitter-Relaxationszeit oder auch -Zeit.
Die -Zeiten in reinen, niedrigviskosen Flüssigkeiten wie z. B. Wasser liegen meist im Bereich von einigen Sekunden. Flüssigkeiten mit höherer Viskosität (z. B. Öle) oder Wasser in strukturierten Systemen wie z. B. Gelen, porösen Materialien oder Gewebe weisen im Allgemeinen kürzere -Zeiten auf. In hoch geordneten Festkörpern werden hingegen sehr lange Relaxationszeiten gefunden, die eventuell im Bereich von Stunden liegen können. Solche Materialien spielen jedoch wegen der kurzen -Zeiten in Festkörpern für die konventionelle Magnetresonanz-Tomographie keine Rolle. Typische Werte für im menschlichen Gewebe liegen zwischen einigen Sekunden für Körperflüssigkeiten wie Blut oder Hirnwasser (Liquor) und ca. 100 ms für Körperfett (beispielsweise beträgt die -Zeit von Liquor bei 1,5 Tesla etwa 4 Sekunden, die -Zeit der grauen Hirnsubstanz ungefähr 1,2 Sekunden[15]).
Spin-Spin-Relaxation (Querrelaxationzeit T2) Bearbeiten
Die Quermagnetisierung eines Spin-Ensembles zerfällt nun, ähnlich wie die -Komponente steigt, durch Wechselwirkung mit benachbarten Atomen. Hier ist es allerdings die sog. Spin-Spin-Wechselwirkung, die für die Dephasierung verantwortlich ist. Der Zerfall lässt sich wieder durch eine Exponentialfunktion darstellen, jedoch mit einer anderen Zeitkonstante :
- .
Oft nimmt die Quermagnetisierung in der xy-Ebene viel schneller ab, als durch die Spin-Spin-Wechselwirkung erklärbar ist. Die Ursache liegt darin, dass bei einer MR-Aufnahme über ein Volumenelement gemittelt wird, in dem das äußere Magnetfeld nicht konstant (sondern inhomogen) ist. Nach Wegnahme des HF-Signals verschieben sich die Phasen der Präzessionsbewegung der Kerne untereinander, und die xy-Komponenten der einzelnen Kernspins laufen auseinander.
Messsequenz, Ortskodierung, Bildaufbau Bearbeiten
Zum besseren Verständnis wird hier das Prinzip der grundlegenden (1950 von Erwin Hahn erfundenen) Spinecho-Sequenz kurz skizziert. Eine „Sequenz“ (auch „Pulssequenz“) ist in diesem Zusammenhang eine Abfolge von Hochfrequenz- und magnetischen Gradientenfeldern, die vielfach in jeder Sekunde in vorgegebener Reihenfolge ein- und ausgeschaltet werden.
Zu Beginn steht ein Hochfrequenzimpuls der passenden Frequenz (Larmor-Frequenz), der sogenannte 90°-Anregungsimpuls. Durch diesen wird die Magnetisierung um 90° quer zum äußeren Magnetfeld ausgelenkt. Sie beginnt um die ursprüngliche Achse zu kreisen. Wie bei einem Kreisel, welcher angestoßen wird, nennt man diese Bewegung Präzession.
Das dabei entstehende Hochfrequenzsignal kann außerhalb des Körpers gemessen werden. Es nimmt exponentiell ab, weil die Protonenspins aus dem „Takt“ geraten („dephasieren“) und sich zunehmend destruktiv überlagern. Die Zeit, nach der 63 % des Signals zerfallen sind, nennt man -Relaxationszeit (Spin-Spin-Relaxation). Diese Zeit hängt von der chemischen Umgebung des Wasserstoffs ab; sie ist für jede Gewebsart unterschiedlich. Tumorgewebe hat z. B. meist eine längere -Zeit als normales Muskelgewebe. Eine -gewichtete Messung stellt den Tumor darum heller als seine Umgebung dar.
Durch einen geeigneten 180°-Rephasierungs-Hochfrequenzimpuls kann man bewirken, dass ein Teil der Dephasierung ( -Dephasierung durch zeitlich unveränderliche Magnetfeldinhomogenitäten) zum Zeitpunkt der Messung wieder rückgängig gemacht wird, so dass wieder mehr Spins in der gleichen Phase sind. Die Signalstärke hängt dann nicht von der -Relaxationszeit ab, sondern nur noch von der -Relaxationszeit, die auf nicht-reversiblen Effekten beruht. Abhängig von den Sequenz-Parametern kann das Signal darüber hinaus auch von der sogenannten -Relaxationszeit (Spin-Gitter-Relaxation) abhängen, die ein Maß für die Geschwindigkeit ist, mit der sich die ursprüngliche Längsausrichtung der Spins zum äußeren Magnetfeld wieder einstellt. Die -Zeit ist ebenfalls gewebespezifisch, aber in der Regel deutlich (5× bis 20×) länger als die -Zeit. Die -Zeit von Wasser beträgt z. B. 2,5 Sekunden. -gewichtete Messsequenzen erlauben wegen des stärkeren Signals eine bessere Ortsauflösung, aber einen geringeren Gewebekontrast als -gewichtete Bilder.
Um eine -gewichtete Aufnahme zu erhalten, setzt man den Rephasierungsimpuls relativ spät, so dass die Spin-Spin-Relaxation Zeit hat, sich auszuwirken; man spricht von einer langen Echozeit TE. Auch der zeitliche Abstand bis zur nächsten Messung ist sehr lang, damit die Spin-Gitter-Relaxation in allen Geweben ebenfalls vollständig ablaufen kann und die Folgemessung überall wieder voll anregen kann. Man spricht von einer langen Repetitionszeit TR. Mit langer TE und langer TR bekommt man helles Signal nur von Geweben mit langer -Zeit. Für eine -Wichtung braucht man umgekehrt kurze TE und kurze TR, dann überwiegen die unterschiedlichen Spin-Gitter-Relaxationen verschiedener Gewebe im Bildkontrast. Eine Sequenz mit kurzer TE und langer TR erzeugt einen Kontrast, der sich nur nach der Konzentration der Protonen im Gewebe richtet, die praktisch der Anzahl der Wasserstoffatome entspricht. Diese sogenannten Proton density (PD)-gewichteten Aufnahmen haben einen flauen Kontrast, aber eine hohe Ortsauflösung. Es gibt zahlreiche Weiterentwicklungen dieser einfachen Spinecho-Sequenzen, etwa zur Beschleunigung, oder mit Unterdrückung des Fettgewebesignals. Eine klinische MRT-Untersuchung umfasst unterschiedlich gewichtete Bildserien und mehrere räumlichen Ebenen.
Um die Signale den einzelnen Volumenelementen (Voxeln) zuordnen zu können, wird mit linear ortsabhängigen Magnetfeldern (Gradientenfeldern) eine Ortskodierung erzeugt. Dabei wird ausgenutzt, dass für ein bestimmtes Teilchen die Larmorfrequenz von der magnetischen Flussdichte abhängt (je stärker der Feldanteil rechtwinklig zur Richtung des Teilchendrehimpulses, desto höher die Larmorfrequenz):
- Ein Gradient liegt bei der Anregung an und stellt sicher, dass nur eine einzelne Schicht des Körpers die passende Larmorfrequenz besitzt, also nur die Spins dieser Schicht ausgelenkt werden (Schichtselektionsgradient).
- Ein zweiter Gradient quer zum ersten wird nach der Anregung kurz eingeschaltet und bewirkt eine kontrollierte Dephasierung der Spins dergestalt, dass die Spins in jeder Bildzeile unterschiedlich schnell dephasieren, was das Summensignal schwächt (Phasenkodiergradient). Diese Messung wird mit inkrementell veränderter Gradientenstärke so oft wiederholt, wie Bildzeilen berechnet werden sollen. Die Signalschwächung durch Dephasierung verändert sich abhängig von der Position der sendenden Spins entlang des Gradienten.
- Der dritte Gradient wird während der Messung rechtwinklig zu den beiden anderen geschaltet; er sorgt dafür, dass die Spins jeder Bildspalte eine andere Präzessionsgeschwindigkeit haben, also eine andere Larmorfrequenz senden (Auslesegradient, Frequenzkodiergradient).
Die Messungen werden zeilenweise in eine Matrix („k-Raum“) eingetragen. Der k-Raum enthält in der Horizontalen also das Summensignal der horizontalen Ortsfrequenzen, und in der Vertikalen die Summe der vertikalen Ortsfrequenzen. Mit einer zweidimensionalen Fourier-Transformation werden die Beiträge der einzelnen Frequenzen getrennt, d. h. für jedes Voxel die Signalstärke ermittelt. Alle drei Gradienten zusammen bewirken eine Kodierung des Signals in drei Raumebenen. Das empfangene Signal gehört zu einer bestimmten Schicht des Körpers und enthält eine Kombination aus Frequenz- und Phasenkodierung, die der Computer mit einer inversen Fourier-Transformation in ein zweidimensionales Bild umrechnen kann.
Verwendete magnetische Flussdichten Bearbeiten
Die magnetische Flussdichte wirkt sich unmittelbar auf die Signalqualität der gemessenen Daten aus, da das Signal-Rausch-Verhältnis ungefähr proportional zur Flussdichte ist. Deshalb gibt es seit den Anfängen der MRT einen Trend zu immer höheren Flussdichten, der den Einsatz tiefgekühlter supraleitender Spulen für die Erzeugung der Magnetfelder erfordert. Dadurch steigen die Kosten und der technische Aufwand bei höheren Flussdichten deutlich an. Besonders bei supraleitenden Spulen mit großen Öffnungen für die Untersuchung von Menschen kann die Homogenität des Magnetfelds abnehmen.
Niederfeldgeräte mit 0,1–1,0 T (Tesla) sind heute mit Permanentmagneten betrieben als Laborgeräte für technische oder Kleintieruntersuchungen im Einsatz. Bei Kryo-Elektromagneten in der Humanmedizin liegt die Flussdichte für diagnostische Zwecke heute üblicherweise bei 1,5 T bis 3,0 T. Werden 3 T überschritten, dürfen die Patienten oder Probanden nur sehr langsam in den Bereich der supraleitenden Spule gefahren werden, da es infolge der entstehenden Wirbelströme im Gehirn sonst zu Blitzerscheinungen, Schwindel und Übelkeit kommen kann.
Etwa seit 2005 werden mit 7 Tesla höhere Flussdichten (Ultrahochfeld-Systeme) in der Humanmedizin erforscht. Seit 2017 sind diese Systeme für routinemäßige klinische Untersuchungen zugelassen.[16] Sie werden inzwischen in der medizinischen Praxis mehr und mehr genutzt. So können Erkrankungen des Gehirns, wie zum Beispiel die läsionale fokale Epilepsie sichtbar gemacht werden.[17]
An folgenden Institutionen wurden seit 2005 höhere Flussdichten als 3 Tesla eingeführt und erforscht:
- das Leibniz-Institut für Neurobiologie (IfN) in Magdeburg (7-Tesla-Gerät für Kopfuntersuchungen, seit 2005; 4,7-Tesla-System für Untersuchungen an Kleintieren, seit 2018)[18][19][20]
- das Erwin L. Hahn Institut für Magnetresonanz[21] der Universitäten Duisburg-Essen und Radboud (Nijmegen) (7-Tesla-Ganzkörper-MRT, seit 2006)
- das Institute for Biomedical Engineering (IBT)[22] der ETH Zürich (7-Tesla-Ganzkörper-MRT, seit 2006)[23]
- das Max-Planck-Institut für biologische Kybernetik in Tübingen (9,4-Tesla-System für Kopfuntersuchungen, seit 2007; 14,1-Tesla-System für Untersuchungen an Kleintieren)[24]
- das Allgemeine Krankenhaus der Stadt Wien als Teil der Medizinischen Universität Wien (7-Tesla-Ganzkörper-MRT, seit 2008)[25]
- das Max-Planck-Institut für Kognitions- und Neurowissenschaften in Leipzig (7-Tesla-Gerät für Kopfuntersuchungen, seit 2008)[26]
- das Deutsche Krebsforschungszentrum in Heidelberg (7-Tesla-Ganzkörper-MRT, seit 2008)[27][28]
- das Max-Delbrück-Centrum für Molekulare Medizin in Berlin (7-Tesla-Ganzkörper-MRT, Nutzbarkeit von 2009 an)[29][30]
- das Forschungszentrum Jülich (9,4-Tesla-MR-PET-Hybridsystem für Kopfuntersuchungen, von April 2009 bis Anfang 2014)[31]
- das Universitätsklinikum Erlangen gemeinsam mit der Friedrich-Alexander-Universität Erlangen-Nürnberg und Siemens Healthcare[32] (7-Tesla-Ganzkörper-MRT, seit 2015)[33]
- das Universitätsklinikum Würzburg (Deutsches Zentrum für Herzinsuffizienz) (7-Tesla-Ganzkörper-MRT, seit 2017)[34]
- das Universitätsklinikum Bonn (Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE) Bonn)(7-Tesla-MRT für Kopfuntersuchungen, seit 2016)[35][36]
Supraleitende Magnete bleiben bei einem Stromausfall stromführend und magnetisch, wodurch in einem Notfall (Gebäudebrand o. ä.) Rettungskräfte in Gefahr kommen können, indem ferromagnetische Ausrüstungsteile (Atemluftflaschen, …) in die Geräteöffnung gezogen werden.[37] Deswegen werden die Magnete bei der Auslösung eines Feueralarms automatisch gequencht, indem eine dafür vorgesehene Stelle der Spule durch Erwärmen normalleitend gemacht wird, woraufhin sich der Magnet über einen überbrückenden Lastwiderstand kontrolliert entlädt.
Experimentalsysteme Bearbeiten
In der physikalischen, chemischen und biomedizinischen Forschung sind Hochfeldgeräte für Proben und Kleintiere mit bis zu 21 T üblich. Die Öffnung dieser Geräte ist mit einem Durchmesser von wenigen Zentimetern aber wesentlich kleiner als die der zuvor genannten Systeme. Mit solchen Hochfeldtomographen können z. B. Altersbestimmungen von Objekten durchgeführt werden, die chemisch oder radiologisch nicht möglich sind.
Bildbeurteilung Bearbeiten
Die Signalstärke der Voxel wird in Grauwerten kodiert abgebildet. Da sie von zahlreichen Parametern abhängt (etwa der Magnetfeldstärke), gibt es keine Normwerte für das Signal bestimmter Gewebe und keine definierte Einheit, vergleichbar den Hounsfield-Units bei der Computertomographie. Die MR-Konsole zeigt nur arbiträre (willkürliche) Einheiten an, die diagnostisch nicht unmittelbar verwertbar sind. Die Bildinterpretation stützt sich stattdessen auf den Gesamtkontrast, die jeweilige Gewichtung (synonym Wichtung) der Messsequenz und die Signalunterschiede zwischen bekannten und unbekannten Geweben. Im Befund wird deshalb bei der Beschreibung einer Läsion nicht von „hell“ oder „dunkel“ gesprochen, sondern von hyperintens für signalreich, hell und von hypointens für signalarm, dunkel.
Je nach Gewichtung kommen die verschiedenen Gewebe in charakteristischer Intensitätsverteilung zur Darstellung:
- In der T1-Wichtung (T1w) erscheint Fettgewebe hyperintens (signalreich, hell) und damit auch fetthaltige/-reiche Gewebe (z. B. Knochenmark). Diese Gewichtung eignet sich daher gut zur anatomischen Darstellung von Organstrukturen und insbesondere nach Kontrastmittelgabe (Gadolinium) zur besseren Abgrenzbarkeit unbekannter Strukturen (z. B. Tumor).
- In der T2-Wichtung (T2w) erscheinen stationäre Flüssigkeiten hyperintens, so dass flüssigkeitsgefüllte Strukturen (z. B. Liquorräume) signalreich und damit hell erscheinen. Dadurch eignet sich diese Gewichtung zur Darstellung von Ergussbildungen und Ödemen sowie z. B. zur Abgrenzung von Zysten gegenüber soliden Tumoren. Bei Röntgenbildern, insbesondere bei der speziellen Röntgentechnik der Computertomographie (CT), werden im Gegensatz dazu die Begriffe hyperdens und hypodens zur Beschreibung des relativen Schwärzungsgrads benutzt.
- Protonengewichtete Bilder sind flau, aber scharf. Knorpel kann sehr detailliert beurteilt werden. In Verbindung mit einem Fettsättigungsimpuls gehören PD-Bilder deshalb zum Standard in Gelenkuntersuchungen.
In der voxelbasierten Morphometrie werden MR-Bilder algorithmisch weiterverarbeitet, um daraus objektive Parameter zu ermitteln und statistisch zu analysieren. Diese Verfahren kommen insbesondere zum Einsatz, um bei der Untersuchung des menschlichen Gehirns die Größe bestimmter Hirnstrukturen zu erfassen.
Eigenschaften Bearbeiten
Vorteile der Magnetresonanztomographie Bearbeiten
Ein Vorteil der MRT gegenüber anderen bildgebenden Verfahren ist der bessere Weichteilkontrast. Er resultiert aus der Verschiedenheit des Fett- und Wassergehaltes unterschiedlicher Gewebearten. Dabei kommt das Verfahren ohne schädliche ionisierende Strahlung aus. Eine weitere Verbesserung ergibt sich durch zwei Aufnahmeserien, ohne und mit Gabe von Kontrastmitteln, so werden z. B. durch eine intensivere Weißfärbung Entzündungsherde oder auch vitales Tumorgewebe besser erkannt.
Neue, schnellere Aufnahmeverfahren ermöglichen das Scannen einzelner Schnittbilder in Bruchteilen einer Sekunde und liefern auf diese Weise eine wirkliche Echtzeit-MRT, die die bisherigen Versuche in Anlehnung an die konventionelle Fluoroskopie ersetzen. Somit können beispielsweise Bewegungen von Organen dargestellt oder die Position medizinischer Instrumente während eines Eingriffs überwacht werden (interventionelle Radiologie). Zur Abbildung des schlagenden Herzens (Abbildung rechts) werden bisher mit einem EKG synchronisierte Messungen benutzt, wobei Daten aus mehreren Herzzyklen zu vollständigen Bildern kombiniert werden. Neuere Ansätze für die Echtzeit-MRT versprechen dagegen eine direkte Herzbildgebung ohne EKG-Synchronisation sowie bei freier Atmung mit einer zeitlichen Auflösung von bis zu 20 Millisekunden.
Wesentlich ist auch die fehlende Strahlenbelastung, weshalb diese Methode bei Untersuchungen von Säuglingen und Kindern sowie während der Schwangerschaft gegenüber der CT bevorzugt angewandt wird.
Nachteile der MRT Bearbeiten
- Die Auflösung ist bei klinischen Standardsystemen durch technische Gegebenheiten, insbesondere die begrenzte Feldstärke, auf etwa einen Millimeter begrenzt. Im Forschungsbereich können räumliche Auflösungen von unter 0,02 mm erreicht werden.
- Bestimmte Metalle wie ferromagnetische Metalle am oder im Körper können Nebenwirkungen und Bildstörungen verursachen. Vorhandene metallische Fremdkörper (z. B. Eisensplitter im Auge oder Gehirn) können durch Verlagerung oder Erwärmung während der Untersuchung sogar gefährlich werden, so dass eine Kernspin-Untersuchung bei solchen Patienten kontraindiziert sein kann. Metallimplantate aus Titan und selbst Stahllegierungen sind abhängig von der Zusammensetzung para- oder diamagnetisch und stellen damit in der Regel kein Problem in der MRT dar.
- Für MRTs von 1,5 Tesla ist bekannt, dass sie sicher für Amalgamfüllungen sind. Allerdings zeigten türkische Wissenschaftler 2013, dass neuere MRTs mit Feldstärken von 3 und mehr Tesla nicht völlig frei von Auswirkungen auf die Randundichtigkeiten von Amalgamfüllungen sind.[38]
- Elektrische Geräte können im Magneten beschädigt werden. Träger eines älteren Herzschrittmachers und ähnlicher Geräte durften daher bisher nicht untersucht werden. Spezielle Geräte bieten aber die Möglichkeit einer Untersuchung bis üblicherweise 1,5 Tesla, nachdem diese in einen speziellen MRT-Modus geschaltet wurden.[39]
- Cochleäre Implantate oder ähnliche magnetversorgte Hörimplantate können nur mit Einschränkungen der Feldstärke und bestimmter Sequenzen genutzt werden. Die Hersteller dieser Geräte geben MRT-Zulassungen ihrer Implantate aus. Teilweise dürfen Patienten nach operativer Entfernung des Implantatmagneten mit bis zu 3 Tesla untersucht werden. Mögliche Komplikationen sind Entmagnetisierung und Dislokation des Implantatmagneten, Wechselwirkungen mit dem Implantatschaltkreis und Artefakte im MRT-Bild. Eine MRT-Untersuchung sollte nur mit strenger Indikation erfolgen und jedes Mal eine Einzelfallentscheidung des durchführenden Radiologen sein.[40]
- Schnell bewegte Organe wie das Herz lassen sich mit den meisten üblichen Geräten nur mit eingeschränkter Qualität darstellen oder erfordern eine Bewegungskompensation durch zeitliche Mehrfachabtastung. Mit Multikanalsystemen und HF-Empfangsspulen mit zahlreichen parallelbetriebenen Spulenelementen sind diese Untersuchungen durch Verfahren wie die parallele Bildgebung jedoch möglich und halten mehr und mehr Einzug in die klinische Routinediagnostik.
- Die Untersuchung ist im Vergleich zu anderen bildgebenden Verfahren oft zeitaufwendiger.
- Der Kalkgehalt knöcherner Strukturen kann aufgrund der verwendeten Felddichten unter Routinebedingungen nicht quantifiziert werden, da Knochengewebe wenig Wasser und wenig Fett enthält. Knochenerkrankungen, wie z. B. Entzündungen oder Tumoren, sind hingegen aufgrund der gesteigerten Durchblutung und des damit verbundenen Wassergehalts oft besser zu erkennen als mit Röntgen- bzw. Computertomographie-Untersuchungen.
- Sehr selten kann eine allergische Reaktion auf das Kontrastmittel auftreten, wobei MR-Kontrastmittel in der Regel wesentlich besser vertragen werden als jodhaltige Röntgen-Kontrastmittel. Neuerdings werden allerdings vereinzelt kontrastmittelinduzierte nephrogene systemische Fibrosen beobachtet.
- Durch die extrem schnelle Umschaltung der Ströme in den Gradientenspulen kommt es während der Aufnahme mitunter zu lauten Geräuschen. Die Gradientenspulen befinden sich im statischen Magnetfeld und deren Stromleiter werden aufgrund der Lorentzkraft zu Vibrationen angeregt. Je nach gewählter Sequenz ist ein intermittierendes Zirpen, Klopfen, Summen, Rattern oder Sägen zu hören; die Wiederholungsfrequenzen der Bildgewinnung können bis in den kHz-Bereich reichen. Es muss daher bei jeder Messung auf ausreichenden Gehörschutz des Patienten geachtet werden. Zwar wächst die Lorentzkraft mit der Feldstärke, jedoch haben die Sequenzparameter (v. a. räumliche Auflösung) einen deutlich größeren Einfluss auf die Lautstärke während der Messung.[41]
- Der hohe Stromverbrauch für die Direktkühlung, die Klimaanlage und die Lüftungsanlage. Dieser liegt im Betrieb bei 40–100 Kilowatt und im Standby bzw. Bereitschaftsbetrieb bei etwa 10 kW, da einige Komponenten, wie z. B. die Vakuumpumpe, die Kühlung der supraleitenden Spule und Teile der Steuerelektronik auch bei Nichtbenutzung der Anlage nicht abgeschaltet werden dürfen, um die Supraleitung zu erhalten.
- Durch den geringen Durchmesser der Röhre, in die der Patient gefahren wird, kann es zu Beklemmungs- und Angstgefühlen kommen. Mittlerweile gibt es jedoch auch Geräte mit einer etwas größeren Tunnelöffnung von 75 cm (statt 60 cm). Außerdem gibt es spezielle "offene MRT-Geräte", die zwar eine etwas schlechtere Feldhomogenität aufweisen, dafür aber auch dem Arzt Zugriff gewähren, beispielsweise für MRT-geführte Biopsien.
Artefakte Bearbeiten
Im Vergleich zur Computertomographie treten Artefakte (Bildstörungen) häufiger auf und stören die Bildqualität meist mehr. Typische MRT-Artefakte sind:
- Bewegungs- und Flussartefakte
- Rückfaltungsartefakte (Objekt liegt außerhalb des Sichtfelds (Field of View, FOV), jedoch noch innerhalb der Empfangsspule)
- Chemical-Shift-Artefakte (durch unterschiedliche Präzessionsfrequenzen der Fett- und Wasserprotonen)
- Auslöschungs- und Verzerrungsartefakte (durch lokale Magnetfeldinhomogenitäten), sog. Suszeptibilitätsartefakte (diese können aber auch ausgenutzt werden, um z. B. Blutungen im Gehirn zu diagnostizieren)
- Kantenartefakte (im Bereich von Gewebeübergängen mit stark unterschiedlichem Signal)
- Linienartefakte (Hochfrequenzlecks)
- Artefakte durch externe Störquellen im Raum wie z. B. Perfusoren und Narkosegeräte älterer Bauart (auch wenn diese relativ weit vom Magneten entfernt sind); sie stellen sich häufig als Streifen in Phasenkodierrichtung dar
- Artefakte infolge von Funkübertragungsgeräten, z. B. 433-MHz-Sender des ISM-Bandes und Bluetooth-Geräte
Kontraindikationen Bearbeiten
- Herzschrittmacher und Defibrillator- sowie THS-Systeme können durch die Untersuchung beschädigt werden oder durch Wechselwirkungen mit den magnetischen Feldern des MRTs zur Schädigung des Patienten führen. So können sich die Kontaktflächen der implantierten Elektroden erwärmen, magnetische Teile des Implantats könnten sich bewegen oder das System kann gänzlich in seiner Funktion gestört werden. Einige Hersteller solcher Implantate haben mittlerweile bedingt MRT-taugliche Systeme entwickelt, die in der Europäischen Union, den USA und Japan zugelassen wurden und die teilweise vorübergehend in einen speziellen MRT-Modus versetzt werden können.[42] Viele Schrittmacher und ICD-Systeme werden heute in kontrollierten klinischen Studien beobachtet.[43][44]
- Metallsplitter oder Gefäßclips aus ferromagnetischem Material in ungünstiger Lage (z. B. im Auge oder im Gehirn)
- Temporärer Cava-Filter
- Während eine Kernspintomografie auch während der Schwangerschaft unbedenklich ist, führt die Gabe von Gadolinium-haltigem Kontrastmittel zu einer deutlich erhöhten Todesrate des Neugeborenen bei oder nach der Geburt mit einer Hazard ratio (HR) von 3,7 und zu einer erhöhten Wahrscheinlichkeit rheumatologischer, inflammatorischer und dermatologischer Erkrankungen mit einer Hazard Ratio von 1,36. Daher sollte in der Schwangerschaft bei der Kernspintomografie kein Kontrastmittel eingesetzt werden.[45] Hingegen ist die Kernspintomografie ohne Kontrastmittel-Einsatz nicht mit einem erhöhten Risiko für das Ungeborene verbunden. Bei einer kanadischen retrospektiven Kohortenstudie mit über 1,4 Millionen Kindern, die bis zu ihrem 4. Lebensjahr nachverfolgt wurden, zeigte sich bei einer Kernspintomografie kein signifikant erhöhtes Risiko, auch nicht für kongenitale Anomalien, Tumoren oder Seh- oder Hörverlust bei Kernspintomografie im ersten Trimenon, das für Teratogene besonders sensibel ist.
- Cochleaimplantat (Bei manchen Cochleaimplantaten ist ein MRT unter Befolgung genauester Anweisungen des Herstellers des Cochleaimplantates möglich. So müssen z. B. bestimmte MRT-Geräte oder Feldstärken verwendet werden und das Cochleaimplantat im Kopf mit einem zusätzlichen Druckverband fixiert / gesichert werden.)
- Implantierte Insulinpumpen (externe Pumpen müssen zur Untersuchung abgelegt werden)
- Bei Klaustrophobie (= „Raumangst“) ist die Untersuchung in Sedierung oder Narkose möglich
- Piercings aus leitfähigen Materialien sollten abgenommen oder während der Untersuchung beobachtet werden, weil sie sich erwärmen können. Tätowierungen können Bildstörungen verursachen, sind ansonsten aber ungefährlich.[46] Es gibt nur vereinzelt Berichte über Missempfindungen.[47]
Liste von Abkürzungen gebräuchlicher MRT-Sequenzen Bearbeiten
| Abkürzung | Erklärung | Synonym |
|---|---|---|
| CE-FAST: Contrast Enhanced Fast Acquisition in the Steady State | GE mit SE-Anteil durch Ausnutzung der Gleichgewichtsmagnetisierung | PSIF, CE-GRASS |
| CISS: Constructive Interference in Steady State | Zwei GE-Sequenzen, deren Einzelsignale konstruktiv addiert werden | |
| CORE: Clinically Optimized Regional Exams | ||
| CSFSE: Contiguous Slice Fast-acquisition Spin Echo | ||
| CSI: Chemical Shift Imaging | ||
| DANTE: Delays Alternating with Nutations for tailored excitation | Serie von Pulsen | |
| DE-FLASH: Doppelecho – Fast Low Angle Shot | ||
| DEFAISE: Dual Echo Fast Acquisition Interleaved Spin Echo | ||
| DEFGR: Driven Equilibrium Fast Grass | ||
| DESS: Double Echo Steady State | Doppel-GE-Sequenz, bei der die Signale zu einem addiert werden | |
| EPI: Echo Planar Imaging | Multiple GE nach einer Anregung; oft alle Rohdaten in einem Pulszug | |
| EPSI: Echo Planar Spectroscopic Imaging | ||
| FADE: Fast Acquisition Double Echo | ||
| FAISE: Fast Acquisition Interleaved Spin Echo | ||
| FAST: Fast Acquired Steady state Technique | GE mit Ausnutzung der Gleichgewichtsmagnetisierung | FISP |
| FEER: Field Echo with Even echo Rephasing | ||
| FFE: Fast Field Echo | GE mit Kleinwinkelanregung | FISP |
| FISP: Fast Imaging with Steady state Precession | GE mit Ausnutzung der Gleichgewichtsmagnetisierung | |
| FLAIR: Fluid Attenuated Inversion Recovery | SE mit vorgeschaltetem 180°-Puls, lange Inversionszeit zur Unterdrückung des Flüssigkeitssignals | |
| FLAME: Fast Low Angle Multi-Echo | ||
| FLARE: Fast Low Angle with Relaxation Enhancement | ||
| FLASH: Fast Low Angle Shot | GE mit Kleinwinkelanregung, üblicherweise mit HF-Spoiling | T1-FFE, Spoiled GRASS, SPGR |
| GRASS: Gradient Refocused Acquisition in the Steady State | GE mit Ausnutzung der Gleichgewichtsmagnetisierung | FISP, FAST |
| GE: Gradienten-Echo | GRE | |
| HASTE: Half fourier-Acquired Single shot Turbo spin Echo | Turbo-SE mit Half-Fourier-Akquisition, alle Rohdaten in einem Pulszug | |
| IR: Inversion Recovery | SE o.a. mit vorgeschaltetem 180°-Puls | |
| IRABS: Inversion Recovery Fast Grass | ||
| LOTA: Long Term Averaging | ||
| MAST: Motion Artifact Suppression Technique | ||
| MPGR: slice-MultiPlexed Gradient Refocused acquisition with steady state | ||
| MP-RAGE: Magnetization Prepared Rapid Gradient Echo | 3D-Variante von Turbo-FLASH | |
| MSE: Modified Spin Echo | ||
| PCMHP: Phasenkontrast-Multi-Herzphasen | ||
| PSIF: Precision Study with Imaging Fast (umgedrehtes FISP) | GE mit SE-Anteil durch Ausnutzung der Gleichgewichtsmagnetisierung | CE-FAST, CE-GRASS |
| RARE: Rapid Acquisition with Relaxation Enhancement | SE mit mehreren 180°-Pulsen, pro Echo eine Rohdatenzeile | TSE, FSE |
| RASE: Rapid Acquisition Spin Echo | ||
| RASEE: Rapid Acquisition Spin Echo Enhanced | ||
| SE: Spin-Echo | 90°–180°-Pulsfolge | |
| SENSE: Sensitivity-Encoded | ||
| SMASH: Simultaneous Acquisition of Spatial Harmonics | ||
| SPGR: Spoiled Gradient Recalled Acquisition in the Steady State | Gradienten-Echo mit Spoilern | FLASH |
| STE: Stimulated Echo | ||
| STEAM: Stimulated Echo Acquisition Mode | Pulsfolge mit drei 90°-Pulsen | |
| SPIR: Spectral Presaturation with Inversion Recovery | Fett-Unterdrückung | |
| SR: Saturation Recovery Sequence | SE o.a. mit vorgeschaltetem 90°-Puls | |
| SSFP: Steady State Free Precession | ||
| STIR: Short-Tau Inversion Recovery | ||
| TFL: Turbo Flash | ||
| TGSE: Turbo Gradient Spin Echo | Turbo-SE-Sequenz, bei der die SE von GE umgeben sind | GRASE |
| TIRM: Turbo-Inversion Recovery-Magnitude | Turbo-SE mit vorgeschaltetem 180°-Puls, Darstellung des Absolutsignals | |
| TRUE-FISP: True Fast Imaging With Steady Precession | GE mit Ausnutzung der Gleichgewichtsmagnetisierung, alle Gradienten sym. | SSFP |
| TRUFI: True Fast Imaging With Steady Precession | ||
| Turbo-FLASH: Turbo Fast Low Angle Shot | FLASH mit vorgeschaltetem 180°-Puls (IR) oder 90°-Puls (SR) | |
| TSE: Turbo-Spin-Echo | SE mit mehreren 180°-Pulsen, pro Echo eine Rohdatenzeile | FSE, RARE |
| UTE: Ultra-short Echo Time | Sehr kurze Echozeiten im Mikrosekundenbereich | |
| UTSE: Ultra-fast Turbo Spin-Echo | ||
| VIBE: Volume Interpolated Breathhold Examination |
Untersuchungsdauer bei einer Magnetresonanztomographie Bearbeiten
Die Dauer einer MRT-Untersuchung hängt vom untersuchten Körperabschnitt, der klinischen Fragestellung und dem verwendeten Gerät ab. Die häufig durchgeführte Untersuchung des Kopfes dauert typischerweise 10–30 Minuten, eine Lendenwirbelsäulen-Untersuchung in der Regel etwa 20 Minuten. Je höher die gewünschte Detailauflösung, desto länger ist die zu veranschlagende Untersuchungszeit. Häufig werden zwei Aufnahmeserien erstellt, zuerst eine ohne Kontrastmittel, danach mit Kontrastmittel.
Die Untersuchungszeit muss bei der Auswahl des Diagnoseverfahrens berücksichtigt werden. Die Fähigkeit eines Patienten, während der erforderlichen Zeit still zu liegen, kann individuell und krankheitsabhängig eingeschränkt sein. Zur MRT-Untersuchung von Säuglingen und Kleinkindern ist gewöhnlich eine Sedierung oder Narkose erforderlich.
Neuere Entwicklungen versprechen, die Untersuchungszeit durch die parallele Aufnahme des MR-Signals mit zahlreichen Empfangsspulen deutlich zu verkürzen, sodass im Extremfall Aufnahmezeiten von unter einer Sekunde möglich sind.
Kosten und Statistik von MRT-Untersuchungen (Deutschland) Bearbeiten
Die Preise für eine MRT-Untersuchung richten sich in Deutschland nach der Gebührenordnung für Ärzte und liegen je nach Organ und Aufwand der Untersuchung zwischen 140 und 1200 Euro.[48] Die Gesetzliche Krankenversicherung vergütet für ihre Versicherten nach dem Einheitlichen Bewertungsmaßstab, der deutlich niedrigere Preise (90–125 Euro) festlegt. Spezielle Verfahren (Herz-MRT, Ganzkörperuntersuchungen, Gefäßdarstellungen, Mamma-MRT) werden von den gesetzlichen Versicherungen nur zum Teil oder gar nicht bezahlt, z. B. weil der Nutzen der Untersuchung bislang nicht belegt ist oder weil die Nebenwirkungen in Form von Fehl- und Überdiagnosen zu hoch sind. Die Erstellungskosten liegen nach Angaben von Radiologen teilweise so hoch, dass die Geräte nur mit Mischkalkulationen und zusätzlichen Privatleistungsangeboten betrieben werden können.
2009 erhielten in Deutschland rund 5,89 Millionen Menschen mindestens eine Magnetresonanztomographie. Der stellvertretende Vorstandsvorsitzende der Barmer GEK, Rolf-Ulrich Schlenker, gab im Januar 2011 die geschätzten Jahresgesamtkosten für Computertomographie (CT) und MRT-Untersuchungen mit 1,76 Milliarden Euro an.[49]
| Jahr | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MRT-Untersuchungen | 6.003.944 | 6.260.293 | 6.894.000 | 7.353.000 | 7.945.000 | 8.624.000 | 8.874.000 | 9.270.000 | 10.018.000 | 10.637.000 | 11.322.130 | 11.812.067 |
| MRT-Geräte | 1.640 | 1.762 | 1.845 | 1.938 | 2.060 | 2.211 | 2.317 | 2.305 | 2.332 | 2.470 | 2.747 | 2.840 |
Kursive Werte stellen Schätzwerte dar.
Bildgalerie Bearbeiten
-
Einzelbild einer Magnetresonanz- tomographie eines menschlichen Gehirns; animierte Version mehrerer transversaler Schnittebenen
-
Schnitt durch den Kopf eines Menschen, die Nase befindet sich links; animierte Version mehrerer sagittaler Schnittebenen
-
MRT des menschlichen Herzens, Vierkammerblick; animierte Version
-
MRT des menschlichen Herzens, Sagittalansicht; animierte Version
-
MRT des Sprunggelenks in T1-Wichtung
-
Mehrkanal-Empfangsspule eines Magnetresonanztomographen, z. B. für Aufnahmen des Herzens
-
Energieversorgungseinheit
-
MRT-Gerät (Philips Achieva 3.0 T)
Hersteller von MRT-Anlagen Bearbeiten
- Agilent (vor 2010 zu Varian)
- Aspect Imaging
- Aurora Imaging Technology, Inc.
- Bruker (Hochfeld-Forschungstomographen)
- Canon Medical Systems (vormals Toshiba)
- Esaote (Niederfeld-Tomographen mit Permanentmagnet für die Extremitätendiagnostik)
- Fonar Corp., in Europa durch Tecserena
- GE Healthcare
- Hitachi Medical Systems
- Ningbo Xingaoyi Magnetism (XGY)
- Paramed Medical Systems (MROpen)
- PhiHealth (Partnerschaft mit Cerner Corporation)
- Philips
- Siemens Healthineers
- SternMed
- Time Medical Holdings Company Limited
- United Imaging
Datenformat Bearbeiten
Für die Speicherung und Archivierung der Ergebnisse medizinischer bildgebender Verfahren hat sich der DICOM-Standard weitgehend durchgesetzt. Oft wird dem Patienten nach der Untersuchung ein Datenträger (z. B. CD-ROM oder DVD-ROM) mit seinen eigenen Schnittbildern mitgegeben, die er dann an den behandelnden Arzt weiterreicht. Häufig werden diese Bilder nicht in ein gebräuchlicheres Grafikformat wie z. B. JPEG umgewandelt, so dass der Patient zum Betrachten ein gesondertes Anzeigeprogramm benötigt. Oft ist ein solches auf dem Datenträger enthalten, das neben der Darstellung der DICOM-Bilder unter Umständen auch Zusatzfunktionen wie Vermessungen oder Lupenwerkzeuge anbietet.
Literatur Bearbeiten
- Peter A. Rinck: Magnetic Resonance in Medicine. The Basic Textbook of the European Magnetic Resonance Forum. 8. Auflage. The Round Table Foundation, 2014 (magnetic-resonance.org).
- Olaf Dössel: Bildgebende Verfahren in der Medizin. Von der Technik zur medizinischen Anwendung. Springer, Berlin 2000, ISBN 3-540-66014-3.
- Heinz Morneburg (Hrsg.): Bildgebende Systeme für die medizinische Diagnostik. 3. Auflage. Publicis MCD, München 1995, ISBN 3-89578-002-2.
- Donald W. McRobbie, Elizabeth A. Moore, Martin J. Graves, Martin R. Prince: MRI from Picture to Proton. Cambridge University Press, Cambridge 2002, ISBN 0-521-52319-2.
- Fritz Schick: MRT-Sequenzen. In: Der Radiologe. Band 9. Springer, 2006, ISSN 0033-832X.
- Maximilian Reiser, Wolfhard Semmler (Hrsg.): Magnetresonanztomographie. Springer, Berlin 1997, ISBN 3-540-61934-8.
- Wolfgang R. Nitz, Val M. Runge, Stuart H. Schmeets, William H. Faulkner, Nilesh K. Desai: Praxiskurs MRT. Anleitung zur MRT-Physik über klinische Bildbeispiele. Thieme, Stuttgart 2007, ISBN 978-3-13-139721-8.
- Christoph Zink, Christoph U. Herborn: Klinikwörterbuch MRT. ABW, Berlin 2007, ISBN 978-3-936072-57-0.
- Roland Tammer, Sabine Hofer, Klaus-Dietmar Merboldt, Jens Frahm: Magnetic Resonance Imaging of the Rhesus Monkey Brain. Vandenhoeck & Ruprecht, Göttingen 2009, ISBN 978-3-525-40424-9.
- Lothar Dilcher: Handbuch der Kernspintomographie. Texte zum Einstieg, Diagramme zum Mitdenken, Formeln für Interessierte. 3., überarbeitete Auflage. E. Ferger Verlag, Bergisch Gladbach 2004, ISBN 3-931219-21-6.
- Merrill Simon, James S. Mattson: The pioneers of NMR and magnetic resonance in medicine: The story of MRI. Bar-Ilan University Press, Ramat Gan, Israel 1996, ISBN 0-9619243-1-4.
- E. Mark Haacke, Robert F. Brown, Michael Thompson, Ramesh Venkatesan: Magnetic resonance imaging: Physical principles and sequence design. J. Wiley & Sons, New York 1999, ISBN 0-471-35128-8.
- P. Mansfield: NMR Imaging in Biomedicine: Supplement 2 Advances in Magnetic Resonance. Elsevier Science, Oxford 1982, ISBN 0-323-15406-9.
- Eiichi Fukushima: NMR in Biomedicine: The Physical Basis. Springer Science & Business Media, 1989, ISBN 0-88318-609-8.
- Bernhard Blümich, Winfried Kuhn: Magnetic Resonance Microscopy: Methods and Applications in Materials Science, Agriculture and Biomedicine. Wiley, 1992, ISBN 3-527-28403-6.
- Peter Blümer: Spatially Resolved Magnetic Resonance: Methods, Materials, Medicine, Biology, Rheology, Geology, Ecology, Hardware. Hrsg.: Peter Blümler, Bernhard Blümich, Robert E. Botto, Eiichi Fukushima. Wiley-VCH, 1998, ISBN 3-527-29637-9.
- Zhi-Pei Liang, Paul C. Lauterbur: Principles of Magnetic Resonance Imaging: A Signal Processing Perspective. Wiley, 1999, ISBN 0-7803-4723-4.
- Franz Schmitt, Michael K. Stehling, Robert Turner: Echo-Planar Imaging: Theory, Technique and Application. Springer Berlin Heidelberg, 1998, ISBN 3-540-63194-1.
- Vadim Kuperman: Magnetic Resonance Imaging: Physical Principles and Applications. Academic Press, 2000, ISBN 0-08-053570-4.
- Bernhard Blümich: NMR Imaging of Materials. Clarendon Press, 2000, ISBN 0-19-850683-X.
- Jianming Jin: Electromagnetic Analysis and Design in Magnetic Resonance Imaging. CRC Press, 1998, ISBN 0-8493-9693-X.
- Imad Akil Farhat, P. S. Belton, Graham Alan Webb, Royal Society of Chemistry (Great Britain): Magnetic Resonance in Food Science: From Molecules to Man. Royal Society of Chemistry, 2007, ISBN 978-0-85404-340-8.
Weblinks Bearbeiten
- Einführung in die Grundlagen der Magnetresonanzbildgebung E-Learning Website von EMRF (European Magnetic Resonance Forum) / TRTF (The Round Table Foundation), auf Englisch.
- Technische Aspekte der Kernspintomographie: Gradientenecho-Sequenz, Frequenzkodierung und Verschiebungsartefakte (Zahlr. Abb., einschl. Formel der Fourier-Transformation)
- Bigs.de, Animation: Spin; Relaxieren und Präzedieren
- Erklärung und Animation zur Magnetresonanztomographie (Memento vom 29. März 2007 im Internet Archive) bei Quarks & Co
- The Basics of MRI
- A short history of magnetic resonance imaging from a European point of view (Memento vom 10. Dezember 2002 im Internet Archive)
- An Excursion into the History of Magnetic Resonance Imaging. (PDF; 28 MB) magnetic-resonance.org (englisch)
- Chris Rorden: MRIcro software for displaying and analyzing MR images.
- MRI im Einsatz (englisch)
- Lernskript Grundlagen der Magnetresonanztomographie. (PDF; 1,2 MB) Diagnostische und Interventionelle Radiologie, Universitätsklinikum Gießen und Marburg, Standort Marburg
- Lernspiel auf nobelprize.org (englisch)
- Flash-Animationen, welche die Physik anschaulich erklären (englisch)
Einzelnachweise Bearbeiten
- ↑ a b cMRT | Befunddolmetscher. Abgerufen am 13. September 2023.
- ↑ Lernskript Grundlagen der Magnetresonanztomographie. (PDF; 1,2 MB) Diagnostische und Interventionelle Radiologie, Universitätsklinikum Gießen und Marburg, Standort Marburg.
- ↑ Cornelius Borck: Kernspintomographie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 733.
- ↑ P. C. Lauterbur: Image Formation by Induced Local Interactions: Examples of Employing Nuclear Magnetic Resonance. In: Nature. Vol. 242, Nr. 5394, 1973, S. 190–191, doi:10.1038/242190a0, bibcode:1973Natur.242..190L (englisch).
- ↑ P. A. Rinck: The history of MRI. In: Magnetic Resonance in Medicine. 8. Auflage. 2014 (englisch, magnetic-resonance.org).
- ↑ E. Odeblad, G. Lindström: Some preliminary observations on the proton magnetic resonance in biological samples. In: Acta Radiologica. Vol. 43, 1955, S. 469–476 (englisch).
- ↑ A. Geiger, M. Holz: Automation and Control in high power pulsed NMR. In: J. Phys. E: Sci.Instrum. 13, 1980, S. 697–707.
- ↑ P. Mansfield: Multi-planar image formation using NMR spin echoes. In: Journal of Physics C: Solid State Physics. Vol. 10, Nr. 3, 1976, S. L55-L58, doi:10.1088/0022-3719/10/3/004, bibcode:1977JPhC...10L..55M (englisch).
- ↑ J. Hennig, A. Nauerth, H. Friedburg: RARE imaging: A fast imaging method for clinical MR. In: Magnetic Resonance in Medicine. Vol. 3, Nr. 6, 1986, S. 823–833, doi:10.1002/mrm.1910030602 (englisch).
- ↑ A. Haase, J. Frahm, D. Matthaei, W. Hänicke, K. D. Merboldt: FLASH imaging. Rapid NMR imaging using low flip-angle pulses. In: Journal of Magnetic Resonance. Vol. 67, Nr. 2, 1986, S. 258–266, doi:10.1016/0022-2364(86)90433-6, bibcode:1986JMagR..67..258H (englisch).
- ↑ Cornelius Borck: Kernspintomographie. 2005, S. 733.
- ↑ Petra Kau: Untersuchungen über die Darstellbarkeit von Koronargefäßen mit der Magnetresonanztomographie, Peter Wegener-Verlag, Bonn 1993, S. 5
- ↑ nobelprize.org, abgerufen am 30. Dezember 2020.
- ↑ Lars G. Hanson: Is Quantum Mechanics necessary for understanding Magnetic Resonance? In: Concepts in Magnetic Resonance Part A, Band 32A, Nr. 5, 2008, S. 329–340, doi:10.1002/cmr.a.20123, drcmr.dk (PDF; 515 kB).
- ↑ W. D. Rooney u. a.: Magnetic field and tissue dependencies of human brain longitudinal 1H2O relaxation in vivo. In: Magn. Reson. Med. Band 57, 2007, S. 308–318. PMID 17260370; doi:10.1002/mrm.21122
- ↑ 7 Klinische Zulassung erstes 7 Tesla MRT ,. Abgerufen im Mai 2021.
- ↑ 7 Tesla mr zieht in die praxis ein,. Abgerufen im Mai 2021.
- ↑ 7-Tesla-Ultrahochfeld-Kernspintomograph, Hirnforschung. Abgerufen am 21. Juli 2020.
- ↑ LIN weiht neuen Ultra-Hochfeld-Kleintierscanner ein. Abgerufen am 6. Oktober 2020.
- ↑ AG Funktionelle Neuroanatomie am Leibniz-Institut für Neurobiolgie. Abgerufen am 6. Oktober 2020.
- ↑ Willkommen im Erwin L. Hahn-Institut. Abgerufen am 21. Juli 2020.
- ↑ Institute for Biomedical Engineering (IBT) an der ETH Zürich.
- ↑ Presseinformation von Philips zum 7-Tesla-MRT in Zürich (Memento vom 19. Juli 2011 im Internet Archive).
- ↑ Reise ins Gehirn – Das neue Magnetresonanzzentrum. Max-Planck-Institut, 2019, abgerufen am 21. Juli 2020.
- ↑ Hochfeld-MRT an der Universität Wien.
- ↑ Millionen-Vertrag für 7-Tesla Magnetresonanztomographen unterzeichnet (PDF; 106 kB).
- ↑ Ultrahochfeld-MRT-Arbeitsgruppe am DKFZ in Heidelberg (Memento vom 20. Februar 2009 im Internet Archive).
- ↑ Pressemitteilung des DKFZ in Heidelberg zum 7-Tesla-Ganzkörper-MRT.
- ↑ Pressemitteilung des MDC in Berlin zum 7-Tesla-Ganzkörper-MRT
- ↑ Hochfeld-MRT am MDC in Berlin
- ↑ 9,4-Tesla-MR-PET am Forschungszentrum Jülich.
- ↑ Pressemitteilung der FAU Erlangen-Nürnberg, abgerufen am 20. Oktober 2015.
- ↑ Pressemitteilung des Uniklinikums Erlangen, abgerufen am 20. Oktober 2015.
- ↑ Herzzentrum der Uniklinik Würzburg eröffnet. Abgerufen am 4. Oktober 2017.
- ↑ DZNE Bonn Methoden. Abgerufen am 19. August 2020.
- ↑ Magnetresonanztomograph zieht zum Venusberg – 40 Tonnen am Haken. Abgerufen am 19. August 2020.
- ↑ Infoblatt supraleitende Magneten – MRT. (PDF) Branddirektion München, Berufsfeuerwehr, 2009, archiviert vom (nicht mehr online verfügbar) am 9. Mai 2010; abgerufen am 4. April 2015.
- ↑ S. Yilmaz, M. Misirlioglu: The effect of 3 T MRI on microleakage of amalgam restorations. In: Dento maxillo facial radiology. Band 42, Nummer 8, 2013, S. 20130072. doi:10.1259/dmfr.20130072. PMID 23674614. PMC 3756742 (freier Volltext).
- ↑ Produkte | St. Jude Medical. Abgerufen am 28. Februar 2018.
- ↑ S. Nospes, W. Mann, A. Keilmann: Magnetresonanztomographie bei Patienten mit magnetversorgten Hörimplantaten. In: Der Radiologe, 2013, S. 1026–1032, doi:10.1007/s00117-013-2570-x.
- ↑ Price, David L. and De Wilde, Janet P. and Papadaki, Annie M. and Curran, Jane S. and Kitney, Richard I.: Investigation of acoustic noise on 15 MRI scanners from 0.2 T to 3 T. In: Journal of Magnetic Resonance Imaging. Vol. 13, Nr. 2, 2001, S. 288–293, doi:10.1002/1522-2586(200102)13:2<288::AID-JMRI1041>3.0.CO;2-P (englisch).
- ↑ Bert Hansky: Spezielle MRT-fähige Elektroden. In: Deutsches Ärzteblatt Int. Band 109, Nr. 39, 28. September 2012, S. 643–644, doi:10.3238/arztebl.2012.0643b (aerzteblatt.de).
- ↑ SureScan. ClinicalTrials.gov
- ↑ ProMRI. ClinicalTrials.gov
- ↑ Nicola Siegmund-Schulze: MRT-Untersuchung in der Schwangerschaft: Kontrastmittel kann zu jeder Zeit das Kind schädigen Deutsches Ärzteblatt 2016, Jahrgang 113, Ausgabe 44 vom 9. November 2016, Seite 1987.
- ↑ L. L. Tsai, A. K. Grant u. a.: A Practical Guide to MR Imaging Safety: What Radiologists Need to Know. In: Radiographics: a review publication of the Radiological Society of North America, Inc. Band 35, Nummer 6, Oktober 2015, S. 1722–1737, doi:10.1148/rg.2015150108, PMID 26466181 (Review).
- ↑ Martina F. Callaghan, Clive Negus, Alexander P. Leff, Megan Creasey, Sheila Burns, Janice Glensman, David Bradbury, Elaine Williams, Nikolaus Weiskopf: Safety of Tattoos in Persons Undergoing MRI. In: New England Journal of Medicine. 380, 2019, S. 495, doi:10.1056/NEJMc1811197.
- ↑ Gebührenordnung für Ärzte, Punkt O III: Magnetresonanztomographie
- ↑ hil: MRT laut Barmer Arztreport in Deutschland am häufigsten. In: aerzteblatt.de. 1. Februar 2011, abgerufen am 27. Dezember 2014.
- ↑ Health care utilization. OECD-Bericht, Edition 2019; doi:10.1787/b9194f22-en
- ↑ Health care resources. OECD-Bericht, Edition 2019; doi:10.1787/36551532-en