Diaminomaleonitril
Diaminomaleonitril (DAMN) ist ein tetrameres, d. h. aus vier gleichen Molekülen aufgebautes, Oligomer des Cyanwasserstoffs, das bei der Polymerisation von Blausäure (HCN) entsteht. Die Verbindung kann auch als Abkömmling der Maleinsäure aufgefasst werden, bei der die Carboxygruppen durch Cyanogruppen und die Wasserstoffatome durch Aminogruppen ersetzt sind.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
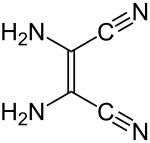
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diaminomaleonitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H4N4 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 108,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,626 (20 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vermutlich spielen HCN-Oligomere wie DAMN eine Rolle bei der chemischen Evolution.[6] Das 1,2-Diamino-1,2-dicyanoethylen ist Baustein für eine Vielzahl von Heterocyclen, wie z. B. Imidazole, Thiadiazole, Pyrazine, Pyrimidine, Pteridine, und Purine.[7]
Geschichte Bearbeiten
Diaminomaleonitril wurde bereits 1873 als schwarzer Feststoff isoliert und als Polymer der Blausäure mit der empirischen Formel (HCN)x erkannt[8], aber erst 1923 ebullioskopisch in Methanol als Tetramer (HCN)4 identifiziert.[1] 1928 wurde durch Reaktion mit Glyoxal zu 2,3-Dicyanopyrazin die cis-Anordnung der Aminogruppen bewiesen und 1955 konnte die Struktur eindeutig als Diaminomaleinsäuredinitril – und nicht als Aminoiminosuccinonitril (AISN) bzw. (trans) Diaminofumaronitril – geklärt werden.[9]
Wesentliche Arbeiten zu Darstellung, Eigenschaften und Reaktionen von Diaminomaleonitril kamen aus dem Arbeitskreis von Hellmut Bredereck.[10][11][12]
Vorkommen und Darstellung Bearbeiten
Wegen des ubiquitären Vorkommens von Cyanwasserstoff und seiner Oligomeren im Weltraum wurde die Hypothese aufgestellt, dass die dunkle Masse auf Kometen auf Diaminomaleonitril und höhere Oligomere zurückzuführen ist, und auch die Oberfläche der frühen Erde von HCN-Polymeren bedeckt gewesen sein könnte.[13][14]
Diaminomaleonitril entsteht in geringem Umfang als dunkelbrauner bis schwarzer Feststoff bei längerer Lagerung von HCN-Gas. In Gegenwart katalytischer Mengen von Triethylamin oder neutralem Aluminiumoxid wird es innerhalb von Stunden in verunreinigter Form gebildet, aus der es durch Extraktion, Fällung und Umkristallisation – meist unter erheblichen Ausbeuteverlusten – als farblose Substanz isoliert werden kann.
Flüssige Blausäure in Toluol reagiert mit Trimethylamin und Dicyan als Katalysator bei −10 °C in 84 % Ausbeute zu DAMN.[15]
Mit stöchiometrischen Mengen (intermediär gebildetem) Dicyan reagiert Cyanwasserstoff in Gegenwart von Triethylamin bei −40 °C zu Diiminosuccinonitril DISN[16], das z. B. mit Wasserstoff an einem Palladium-Kontakt in ca. 90 % Ausbeute zu DAMN reduziert werden kann.[17]
Oligomerisierung von Blausäure in Gegenwart des Ziegler-Natta-Cokatalysators Triethylaluminium AlEt3 liefert DAMN als weiße Nadeln in 96 % Ausbeute.[18]
Im Labor kann DAMN unter Vermeidung von flüssigem oder gasförmigem Cyanwasserstoff auch aus dem Tosylat des Aminomalonitrils – eines HCN-Trimers, zugänglich aus Malononitril[19] – und Natriumcyanid einfach in 20–26 % Ausbeute erhalten werden.[20]
Unvollständige Extraktion des reinen Diaminomaleonitrils aus dem tief gefärbten Gemisch mit höheren Polymeren und starke Adsorption des Produkts an die zur Reinigung eingesetzte Aktivkohle sind für hohe Ausbeuteverluste bei der Isolierung verantwortlich.
Die Polymerisation von HCN zu DAMN erfolgt auch spontan und stark exotherm vermutlich über das Dimer Iminoacetonitril (HCN)2 (CAS# 1726-32-5) und das trimere Aminomalononitril (HCN)3 (CAS# 5181-05-5) zum Tetramer DAMN und weiter zum schwarzen und in allen Lösungsmitteln unlöslichen HCN-Polymer (HCN)n (CAS# 26746-21-4), auch als Azulminsäure bezeichnet.[21]
Eigenschaften Bearbeiten
Reines Diaminomaleonitril kristallisiert in Prismen, ist farblos und verfärbt sich bei Lagerung dunkelbraun bis schwarz. Es schmilzt unter Zersetzung und gibt dabei Blausäure und Ammoniak ab.[1] Am besten löst es sich in polaren organischen Lösungsmitteln, wie z. B. Acetonitril, Dimethylformamid, Methanol und Ethanol. Es ist wenig kaltem, besser in heißem Wasser löslich, aus dem es zur Reinigung umkristallisiert werden kann. Im Alkalischen ist DAMN instabil und beim Erhitzen polymerisiert es zu einer schwarzen Masse (Azulminsäure).
Anwendungen Bearbeiten
DAMN als Synthesebaustein für Heterocyclen Bearbeiten
Aus Diaminomaleonitril ist eine Vielzahl von substituierten Imidazolen zugänglich, wie z. B. mit Phosgen das 4,5-Dicyanoimidazolin-2-on oder mit Orthoameisensäuretriethylester das 4,5-Dicyanoimidazol.[22][7]
Unter UV-Bestrahlung wandelt sich 1,2-Diamino-1,2-dicyanoethylen in 5-Aminoimidazol-4-carbonitril AICN um, eine Schlüsselsubstanz für die (präbiotische) Purinsynthese, aus der durch Reaktion mit Cyanwasserstoff die Purinbase Adenin entsteht.
Ein eleganter Weg zur Vorstufe (HPI) des gegen HIV und Hepatitis B wirksamen Virustatikums Tenofovir wurde unlängst berichtet.[23]
Reaktion von DAMN mit Trimethylorthoformiat TMOF in Gegenwart von Trifluoressigsäure TFA erzeugt das Formimidat MADI, das mit (R)-1-Aminopropan-2-ol (durch Decarboxylierung der Aminosäure Threonin) unter Einwirkung von Bariumhydroxid Ba(OH)2 in hoher Ausbeute zu HPI umgesetzt wird.
Aus Diaminomaleinsäuredinitril wird bei Umsetzung mit Thionylchlorid SOCl2 der elektronenarme Aromat 1,2,5-Thiadiazol-3,4-dicarbonitril als Vorstufe für Elektronenakzeptoren mit sehr hohem Elektronendefizit gebildet, die in organischen Solarzellen, Feldeffekttransistoren oder elektrochromen Materialien Verwendung finden könnten.[24]
Derivate des 1,4-Diazins Pyrazin entstehen aus DAMN mit 1,2-Dicarbonylverbindungen, wie z. B. Glyoxal[7]
oder α-Diketonen. Mit 1,3-Diketonen, wie Acetylaceton werden Azepine gebildet.[7]
Intensiv bearbeitet wurden auch Synthesen von biologisch wichtigen Molekülen mit dem Ausgangsstoff DAMN, wie z. B. Pyrimidine, Purine und Pteridine. So liefert die Umsetzung von Diaminomaleonitril mit Guanidin über Orotsäure als Zwischenstufe das Pyrimidinderivat 5-Hydroxyuracil[7], ein Oxidationsprodukt der Nukleinbase Cytosin.
DAMN in der chemischen Evolution Bearbeiten
Diaminomaleonitril wurde bereits in den 1960er Jahren als Schlüsselsubstanz für die präbiotische Synthese von Nukleinbasen vorgeschlagen.[25] Nach der UV-induzierten Umlagerung zum 5-Aminoimidazol-4-carbonitril AICN kann diese Zwischenstufe mit Dicyan zu Guanin, mit Wasser zur 5-Aminoimidazol-4-carboxamid AICA und weiter mit Blausäure zu Adenin umgesetzt werden.[6][26]
Frühe Experimente gaben Anlass zu der Vermutung, dass auch einige Aminosäuren, wie z. B. Asparaginsäure, Alanin und Glycin und Peptide daraus ihren präbiotischen Ursprung bei der sauren Hydrolyse von DAMN gehabt haben könnten.[27][28]
Wegen des ubiquitären Vorkommens von Cyanwasserstoff und seiner Oligomeren im Weltraum wurde die Hypothese aufgestellt, dass die dunklen Masse auf Kometen auf DAMN und höhere Oligomere zurückzuführen sind.[29][30]
Literatur Bearbeiten
- Marta Ruiz-Bermejo, Maria-Paz Zorzano, Susana Osuna-Esteban: Simple Organics and Biomonomers Identified in HCN Polymers: An Overview. In: Life. 3, S. 412–448 (2013), doi:10.3390/life3030421.
- Marta Ruiz-Bermejo, José L. de la Fuente, Javier Carretero Gonzalez, Luis Garcia-Fernandéz, Maria Rosa Aguilar: A Comparative Study on HCN Polymers Synthesized by Polymerization of NH4CN or Diaminomaleonitrile in Aqueous Media: New Perspectives for Prebiotic Chemistry and Materials Science. In: Chemistry. 25, S. 11437–11455 (2019), doi:10.1002/chem.201901911.
Einzelnachweise Bearbeiten
- ↑ a b c d C. Bedel: Sur un polymère de l’acide cyanhydrique. In: Compte Rendu. 1923, S. 168–171 (bnf.fr).
- ↑ a b Datenblatt Diaminomaleonitril bei Sigma-Aldrich, abgerufen am 28. Dezember 2020 (PDF).
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 41.
- ↑ a b Eintrag zu Diaminomaleonitrile bei TCI Europe, abgerufen am 8. Januar 2021.
- ↑ a b c d Datenblatt Diaminomaleonitril bei Alfa Aesar, abgerufen am 28. Dezember 2020 (Seite nicht mehr abrufbar).
- ↑ a b D. Roy, K. Najafian, Paul von Ragué Schleyer: Chemical evolution: The mechanism of the formation of adenine under prebiotic conditions. In: PNAS. Band 104, Nr. 44, 2007, S. 17272–17277, doi:10.1073/pnas.0708434104.
- ↑ a b c d e A. Al-Azimi, A.-Z.A. Elasaar, B.L. Booth: The chemistry of diaminomaleonitrile and its utility in heterocyclic synthesis. In: Tetrahedron. Band 59, Nr. 16, 2003, S. 2749–2763, doi:10.1016/S0040-4020(03)00153-4.
- ↑ O. Lange: Ueber eine neue Verbindung von der Zusammensetzung der Cyanwasserstoffsäure. In: Ber. Dtsch. Chem. Ges. Band 6, Nr. 1, 1873, S. 99–101, doi:10.1002/cber.18730060139.
- ↑ R.L. Webb, S. Frank, W.C. Schneider: The structure of HCN tetramer. In: J. Amer. Chem. Soc. Band 77, Nr. 13, 1955, S. 3491–3493, doi:10.1021/ja01618a021.
- ↑ H. Bredereck, G. Schmötzer, E. Oehler: Darstellung und Eigenschaften der tetrameren Blausäure. In: Justus Liebigs Ann. Chem. Band 600, Nr. 2, 1956, S. 81–86, doi:10.1002/jlac.19566000202.
- ↑ H. Bredereck, G. Schmötzer, H.-J. Becher: Zur Konstitution der tetrameren Blausäure. In: Justus Liebigs Ann. Chem. Band 600, Nr. 2, 1956, S. 87–95, doi:10.1002/jlac.19566000203.
- ↑ H. Bredereck, G. Schmitzer: Die Reaktionen der tetrameren Blausäure. In: Justus Liebigs Ann. Chem. Band 600, Nr. 2, 1956, S. 95–108, doi:10.1002/jlac.19566000204.
- ↑ C.N. Matthews: Dark matter in the solar system: Hydrogen cyanide polymers. In: Origins Life Evol. Biosphere. Band 21, 1991, S. 421–434, doi:10.1007/BF01808312.
- ↑ C.N. Matthews, R.D. Minard: Hydrogen cyanide polymers, comets and the origin of life. In: Faraday Discuss. Band 133, 2006, S. 393–401, doi:10.1039/b516791d.
- ↑ O.W. Webster, D.R. Hartter, R.W. Begland, W.A. Sheppard, A. Cairncross: Hydrogen cyanide chemistry. III. Synthesis of diimino succinonitrile and its conversion to diaminomaleonitrile. In: J. Org. Chem. Band 37, Nr. 25, 1972, S. 4133–4136, doi:10.1021/jo00798a037.
- ↑ Patent US3666787: Preparation of diiminosuccinonitrile from hydrogen cyanide, chlorine and trimethylamine. Angemeldet am 18. März 1970, veröffentlicht am 30. Mai 1972, Anmelder: E.I. du Pont de Nemours and Co., Erfinder: O.W. Webster.
- ↑ Patent US3714222: Preparation of diaminomaleonitrile by chemical reduction of diiminosuccinonitrile. Angemeldet am 3. August 1970, veröffentlicht am 30. Januar 1973, Anmelder: E.I. du Pont de Nemours and Co., Erfinder: D.R. Hartter.
- ↑ Patent US4066683: Process for the preparation of diaminomaleonitrile. Angemeldet am 3. Januar 1977, veröffentlicht am 3. Januar 1978, Anmelder: Nippon Chemicals Co., Ltd., Erfinder: H. Shidara.
- ↑ J.P. Ferris, R.A. Sanchez, R.W. Mancuso: Aminomalononitrile p-Toluenesulfonate In: Organic Syntheses. 48, 1968, S. 1, doi:10.15227/orgsyn.048.0001; Coll. Vol. 5, 1973, S. 32 (PDF).
- ↑ J.P. Ferris, R.A. Sanchez: Diaminomaleonitrile (hydrogen cyanide tetramer) In: Organic Syntheses. 48, 1968, S. 60, doi:10.15227/orgsyn.048.0060; Coll. Vol. 5, 1973, S. 344 (PDF).
- ↑ T. Völker: Polymere Blausäure. In: Angew. Chem. Band 72, Nr. 11, 1960, S. 379–384, doi:10.1002/ange.19600721104.
- ↑ R.W. Begland, D.R. Hartter, F.N. Jones, D.J. Sam, W.A. Sheppard, O.W. Webster, F.J. Weigert: Hydrogen cyanide chemistry. VIII. New chemistry of diaminomaleonitrile. Heterocyclic synthesis. In: J. Org. Chem. Band 39, Nr. 16, 1974, S. 2341–2350, doi:10.1021/jo00930a004.
- ↑ B.P. Derstine et al.: An efficient synthesis of Tenofovir (PMPA): A key intermediate leading to Tenofovir-based HIV medicines. In: Org. Process Res. Dev. Band 24, Nr. 8, 2020, S. 1420–1427, doi:10.1021/acs.oprd.0c00078.
- ↑ T.N. Chmovzh, E.A. Kuyazeva, K.A. Lyssenko, V.V. Popov, O.A. Rakitin: Safe synthesis of 4,7-dibromo[1,2,5]thiadiazolo[3,4-d]pyridazine and its SNAr reactions. In: Molecules. Band 23, Nr. 10, 2018, S. 2576, doi:10.3390/molecules23102576.
- ↑ J.P. Ferris, L.E. Orgel: An unusual photochemical rearrangement in the synthesis of adenine. In: J. Am. Chem. Soc. Band 88, Nr. 5, 1966, S. 1074, doi:10.1021/ja00957a050.
- ↑ Y.A. Jeilani, P.N. Williams, S. Walton, M.T. Nguyen: Unified reaction pathways for the prebiotic formation of RNA and DNA nucleobases. In: Phys. Chem. Chem. Phys. Band 18, Nr. 30, 2016, S. 20177–20188, doi:10.1039/c6cp02686a.
- ↑ R.E. Moser, A.R. Claggett, C.N. Matthews: Peptide formation from diaminomaleonitrile (HCN tetramer). In: Tetrahedron Lett. Band 13, 1968, S. 1599–1603, doi:10.1016/s0040-4039(01)99011-2.
- ↑ C.N. Matthews: Hardware and software in biology: Simultaneous origin of proteins and nucleic acids via hydrogen cyanide polymers. In: J. Biol. Phys. Band 20, 1995, S. 275–281, doi:10.1007/BF00700445.
- ↑ C.N. Matthews: Dark matter in the solar system: Hydrogen cyanide polymers. In: Origins Life Evol. Biosphere. Band 21, 1991, S. 421–434, doi:10.1007/BF01808312.
- ↑ C.N. Matthews, R.D. Minard: Hydrogen cyanide polymers, comets and the origin of life. In: Faraday Discuss. Band 133, 2006, S. 393–401, doi:10.1039/b516791d.
