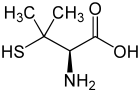
Penicillamin ist eine nicht-proteinogene α-Aminosäure. Es existieren von Penicillamin zwei Enantiomere: D-Penicillamin und L-Penicillamin. Das D-Enantiomer (D-Aminosäure nach D,L-Nomenklatur, oftmals kurz DPA genannt) bzw. (S)-Enantiomer (nach CIP-Nomenklatur) wird als Medikament beim Morbus Wilson eingesetzt. Außerdem kann D-Penicillamin als Chelatbildner bei Schwermetallvergiftungen mit Blei, Cadmium oder Quecksilber angewendet werden oder bei Rheuma. Die L-Variante ist dagegen giftig, da der Körper diese Variante des Penicillamins nicht von anderen proteinogenen Aminosäuren unterscheiden kann.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| L-Penicillamin (links) bzw. D-Penicillamin (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Penicillamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C5H11NO2S | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 149,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
202–206 °C[2] | |||||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser, schwer löslich in Ethanol 96 %[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen Bearbeiten
D-Penicillamin ist eine Vorstufe des Penicillins. In Schimmelpilzarten, die Penicillin auf natürlichem Wege herstellen können, ist es daher ein Zwischenprodukt des natürlichen Stoffwechsels.
Gewinnung und Darstellung Bearbeiten
Der Ausgangsstoff für aus Penicillin synthetisch hergestelltes D-Penicillamin ist die Aminosäure Valin. Alternativ wird D-Penicillamin in einer dreizehnstufigen Synthesekette aus Isobutyraldehyd, Ammoniak und Schwefel hergestellt, mit der Asinger-Reaktion als Startreaktion.[4]
Analytik Bearbeiten
Die Bestimmung der Enantiomerenreinheit kann durch Messung des Drehwertes oder durch chirale Dünnschichtchromatographie erfolgen.[5]
Medizinische Bedeutung Bearbeiten
D-Penicillamin kann als Arzneistoff eingesetzt werden bei
- Morbus Wilson/hepatolentikuläre Degeneration: D-Penicillamin bildet aufgrund seiner molekularen Struktur leicht Chelatkomplexe. Die Thiol-Gruppe besitzt eine hohe Affinität zu Kupfer, dadurch kann das krankheitsbedingt überschüssige Kupfer an das Molekül gebunden und über den Urin aus dem Körper ausgeschieden werden.
- Schwermetall-Vergiftungen: Schwermetalle können irreversibel an Enzyme binden und diese in ihrer Funktion hemmen oder sie vollständig deaktivieren. Hier wird ebenfalls die chelatbildende Eigenschaft von D-Penicillamin ausgenutzt. Das Molekül bindet im Körper vorhandene freie Metallionen. Diese können anschließend ausgeschieden werden.
- Cystinsteinen: Cystin-Harnsteine entstehen, wenn sich übermäßig Cystein und Homocystein unter Bildung einer Disulfidbrücke zusammenballt. Die Thiol-Gruppe des D-Penicillamins vermag diese Disulfidbindungen zu spalten und somit die Harnsteine aufzulösen.
- rheumatoider Arthritis: Es beeinflusst hier bei unbekanntem Wirkmechanismus die Kollagenbildung und führt zu einer Verminderung des Rheumafaktors[6]
- Sklerodermie: verhindert bzw. verbessert teilweise die Induration der Haut und die Beteiligung weiterer Organe[7]
Unerwünschte Wirkungen von Penicillamin (Auswahl, gelegentlich bis häufig):
- Teratogenität: Bei gebärfähigen Frauen ist auf eine wirksame Schwangerschaftsverhütung zu achten.
- Hauterscheinungen (häufig, 1 bis 10 %)
- Nierenschädigung (häufig)
- Knochenmarkschädigungen (häufig)
- Myasthenisches Syndrom (gelegentlich, 0,1 bis 1 %)
Wechselwirkungen mit anderen Arzneimitteln Bearbeiten
Bei gleichzeitiger Anwendung von Goldpräparaten in der Therapie der rheumatoiden Arthritis wird das Gold im Komplex gebunden und somit unwirksam, eine Kombination ist auch mit Azathioprin nicht geeignet, das dies zu einer erhöhten Knochenmarkstoxizität führt. Auch eine gemeinsame Anwendung mit Chloroquin ist kontraindiziert.[6]
Toxizität Bearbeiten
Der LD50-Wert für die orale Gabe des Racemates aus D- und L-Penicillamin liegt im Modellorganismus Ratte bei 365 mg/kg. Für das reine D-Penicillamin sind auch bei einer Dosis von 1200 mg/kg dagegen keinerlei Anzeichen einer Toxizität gegeben.[8]
Handelsnamen Bearbeiten
Artamin (A), Metalcaptase (D), Trolovol
Weblinks Bearbeiten
Einzelnachweise Bearbeiten
- ↑ a b c Eintrag PENICILLAMINE CRS beim Europäisches Direktorat für die Qualität von Arzneimitteln (EDQM), abgerufen am 16. Februar 2009.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1223, ISBN 978-0-911910-00-1.
- ↑ a b Datenblatt D-Penicillamine bei Sigma-Aldrich, abgerufen am 18. April 2011 (PDF).
- ↑ Wolfgang M. Weigert, Heribert Offermanns und Paul Scherberich: D-Penicillamine – Production and Properties. In: Angewandte Chemie International Edition in English. 14, 1975, S. 330–336, doi:10.1002/anie.197503301. PMID 808979.
- ↑ E. Busker, K. Günther, J. Martens: Application of Chromatographic Chiral Stationary Phases to Pharmaceutical Analysis: Enantiomeric Purity of D-Penicillamine, J. Chromatogr. 1985, 350, 179–185. doi:10.1016/S0021-9673(01)93517-49.
- ↑ a b Thomas Karow, Ruth Lang-Roth: Allgemeine und spezielle Pharmakologie und Toxikologie vorlesungsorientierte Darstellung und klinischer Leitfaden für Studium und Praxis 2013; [+ Markierung der Prüfungsfakten des "Hammerexamens" bis 04/2012, + Therapieempfehlungen deutscher und internationaler Fachgesellschaften, + umfassende Dosierungen]. [Selbstverl.], Pulheim 2013.
- ↑ Harrisons Innere Medizin, 18. Auflage, Deutsche Ausgabe, S. 2989.
- ↑ I. A. Jaffe, K. Altman, P. Merryman: The antipyridoxine effect of penicillamine in man. In: The Journal of clinical investigation. Band 43, Oktober 1964, S. 1869–1873, doi:10.1172/JCI105060. PMID 14236210. PMC 289631 (freier Volltext).