Brandi-Guarna-Reaktion
Die Brandi-Guarna-Reaktion ist eine Namensreaktion der organischen Chemie, die nach ihren Entdeckern Alberto Brandi (* 1951) und Antonio Guarna benannt ist. Dabei handelt es sich um eine Umlagerungsreaktion, bei der das Cycloaddukt eines Nitrons mit einem Alkylidencyclopropan unter Hitzeeinwirkung zu einem Tetrahydro-4-pyridon reagiert.[1] Anstatt von Nitronen können auch Nitriloxide eingesetzt werden, was zu einem Dihydro-4-pyridon führt.[2]
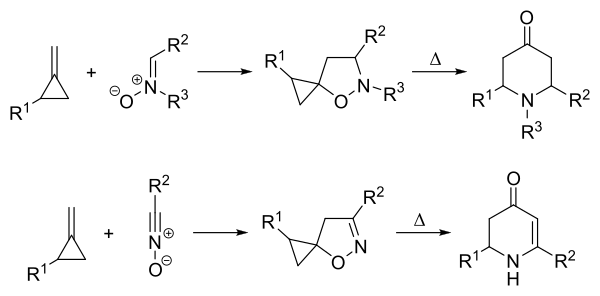
Reaktionsmechanismus Bearbeiten
Es wird vermutet, dass der Mechanismus der Brandi-Guarna-Reaktion radikalische Zwischenstufen enthält. Der darauf basierende Vorschlag für den Reaktionsmechanismus wird im Folgenden dargestellt.[3]
Die Reaktion beginnt mit einer 1,3-dipolaren Cycloaddition mit dem Nitron als 1,3-Dipol und der Doppelbindung des Methylencyclopropans als Dipolarophil, wobei das Isoxazolidin 1 gebildet wird. Bei hohen Temperaturen wird die Stickstoff-Sauerstoff-Bindung homolytisch gespalten, wobei sich das Diradikal 2 bildet. Es folgt eine Umlagerung zum Kohlenstoff-zentrierten Radikal 3a, welches nach Bindungsrotation das Konformationsisomer 3b bildet. Abschließend erfolgt eine intramolekulare Rekombination zum Tetrahydro-4-pyridon 4. Die Triebkraft dieser Reaktion ist die Bildung einer thermodynamisch stabilen C=O-Bindung sowie der Abbau der Ringspannung des Cyclopropans.
Nebenreaktionen Bearbeiten
Je nach Reaktionsbedingungen und Ausgangsverbindungen können mehrere Nebenprodukte entstehen. Bei der 1,3-dipolaren Cycloaddition kann beispielsweise statt der gewünschten Verbindung A auch das 4-Spiro-Regioisomer B entstehen, welches unter diesen Bedingungen keine Umlagerung eingeht und auch isoliert werden kann. Bei N-Aryl-Nitronen steht auch die Umlagerungsreaktion selbst in Konkurrenz mit einer Cyclisierungsreaktion, die das Produkt D, welches einen achtgliedrigen Ring enthält, bildet. Alternativ kann auch im Zwischenprodukt 3a des obenstehenden Mechanismus durch das terminale Radikal ein Wasserstoffatom vom tertiären Kohlenstoffatom neben dem Stickstoffatom abstrahiert werden, wobei ein Imin entsteht, welches zum Nebenprodukt E tautomerisiert. Das eigentliche Produkt C wird in verminderter Ausbeute erhalten.[4]
Praktische Anwendung Bearbeiten
Die Brandi-Guarna-Reaktion findet Anwendung in der Heterocyclenchemie. So wird beispielsweise durch Zugabe von N-Methylhydroxylamin zum untenstehenden Aldehyd in situ ein Nitron gebildet. Bei der intramolekularen Cycloaddition entstehen vier Isomere, genauer das racemische exo-Produkt und das racemische endo-Produkt im Verhältnis 1:1. Letztere können voneinander getrennt und separat zur Umlagerungsreaktion gebracht werden.[5]
Einzelnachweise Bearbeiten
- ↑ Alberto Brandi, Antonio Guarna, Andrea Goti, Francesco De Sarlo: Rearrangement of nitrone cycloadducts to methylene cyclopropane. Synthesis of indolizidine and quinolizidine derivatives. In: Tetrahedron Letters 27, 1986, 1727–1730, doi:10.1016/S0040-4039(00)84358-0.
- ↑ Antonio Guarna, Alberto Brandi, Francesco De Sarlo, Andrea Goti, Fabio Pericciuoli: Rearrangement of isoxazoline-5-spiro derivatives. 1. Synthesis of 4,5-dihydroisoxazole-5-spirocyclopropanes and their rearrangement to 5,6-dihydro-4-pyridones. In: Tetrahedron 53, 1987, 2426–2429, doi:10.1021/jo00246a007.
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley, Hoboken (N.J.) 2010, ISBN 978-0-470-28662-3, S. 515–520.
- ↑ Franca M. Cordero, Andrea Goti, Francesco De Sarlo, Antonio Guarna, Alberto Brandi: Rearrangement of isoxazoline-5-spiro derivatives. part 4. Synthesis of medium size benzofused azaheterocycles. In: Tetrahedron 45, 1989, 5917–5924, doi:10.1016/S0040-4020(01)89118-3.
- ↑ Franca M. Cordero, Federica Pisaneschi, Maria Salvati, Valentina Paschetta, Jean Ollivier, Jacques Salaün, Alberto Brandi: Selective Ring Contraction of 5-Spirocyclopropane Isoxazolidines Mediated by Acids. In: Journal of Organic Chemistry 68, 2003, 3271–3280, doi:10.1021/jo034003g.