Bis(trimethylsilyl)acetylen
Bis(trimethylsilyl)acetylen (BTMSA) ist eine siliciumorganische Verbindung mit einer C-C-Dreifachbindung, die bei Raumtemperatur als farblose Flüssigkeit vorliegt und sich in allen handelsüblichen organischen Lösungsmitteln lösen lässt. Sie findet unter anderem Verwendung als Nucleophil in Acylierungen und Alkylierungen, als Reagenz in Cycloadditionsreaktionen und als Ligand in der metallorganischen Chemie.[2][3]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
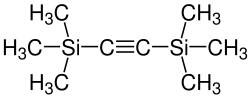
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bis(trimethylsilyl)acetylen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H18Si2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 170,40 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
21–24 °C[1] | |||||||||||||||
| Siedepunkt |
136–137 °C[1] | |||||||||||||||
| Brechungsindex |
1,427 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung Bearbeiten
Die Synthese von Bis(trimethylsilyl)acetylen erfolgt durch die Umsetzung einer Acetylen-Grignard-Verbindung mit Chlortrimethylsilan mit 48 % Ausbeute.[4] Reaktion mit Li2C2 (BuLi + Acetylen) statt Acetylen-Grignard liefert BTMSA in 85 % Ausbeute.[5] BTMSA lässt sich in einer Lithiumchlorid-Kaliumchlorid-Schmelze bei 400 °C aus technischem Calciumcarbid und Chlortrimethylsilan ohne Lösungsmittel mit 77 % Ausbeute darstellen.[6]
Mit einer Ausbeute von 77 % bezüglich des umgesetzten Chlortrimethylsilans wird BTMSA erhalten, das sich leicht und in reiner Form von dem Nebenprodukt Hexamethyldisiloxan und restlichem nicht umgesetzten Chlortrimethylsilan abtrennen lässt. Diese Vorgehensweise ermöglicht somit eine lösungsmittelfreie Darstellung mit besserer Ausbeute und leichter zugänglichen Ausgangsstoffen als die Synthese ausgehend von der Acetylen-Grignard-Verbindung.[6]
Anwendungen Bearbeiten
Bis(trimethylsilyl)acetylen wird als Nucleophil in Friedel-Crafts-Acylierungen und -Alkylierungen und als Vorprodukt von Lithium(trimethylsilyl)acetyliden verwendet.[2] Außerdem wird es als Startreagenz in der Synthese von funktionalisierten 1,2-Bis(trimethylsilyl)benzolen benutzt, welche wiederum als Startmaterial für die Synthese von Lewissäure-Katalysatoren sowie bestimmten Leuchtmitteln dienen.[7] Bei cobaltkatalysierten Reaktionen kommt BTMSA zum Einsatz, um eine Chemoselektivität und Funktionalität (in Form der Trimethylsilylgruppe) zu bewirken, was die Darstellung komplexer Moleküle ermöglicht.[8]
Eine wichtige Anwendung ist zudem die Nutzung im Rosenthal-Reagenz zur Stabilisierung von Titanocen- und Zirconocenfragmenten.[3] Die Verwendung von BTMSA als Ligand von ansonsten instabilen Metallocenverbindungen erlaubt die Synthese anspruchsvoller organischer Strukturen, z. B. Makrocyclen und Heterometallacyclen, selektiv und mit hohen Ausbeuten.[9][10]
Einzelnachweise Bearbeiten
- ↑ a b c d e f g h Datenblatt Bis(trimethylsilyl)acetylene bei Sigma-Aldrich, abgerufen am 10. Oktober 2018 (PDF).
- ↑ a b Michael L. Curtin, Cheng Wang: Bis(trimethylsilyl)acetylene. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2008, ISBN 978-0-471-93623-7, doi:10.1002/047084289x.rb209.pub2.
- ↑ a b A. Ohff, S. Pulst, C. Lefeber, N. Peulecke, P. Arndt: Unusual Reactions of Titanocene- and Zirconocene-Generating Complexes. In: Synlett. Band 1996, Nr. 2, Februar 1996, S. 111–118, doi:10.1055/s-1996-5338.
- ↑ A G. P. Yurevich, O. A. Malchenko, N. V. Zotchik, I. A. Rubtsov: Investigations belated to the synthesis of vitamin A. In: Pharm. Chem. J. Band 7, 1973, S. 573–575, doi:10.1007/BF00757662.
- ↑ Walton, D.R.M.; Waugh, F: Friedel-crafts reactions. crafts reactions of bis(trimethylsilyl)polyynes with acyl chlorides; a useful route to terminal-alkynyl ketones. In: Journal of Organometallic Chemistry. Band 37, 1972, S. 45–56 (doi:10.1016/S0022-328X(00)89260-8).
- ↑ a b Jürgen Stenzel, Wolfgang Sundermeyer: Chemische Reaktionen in Salzschmelzen, XIV. Über die Darstellung von Bis(trimethylsilyl)carbodiimid und Bis-trimethylsilyl-acetylen. In: Chemische Berichte. Band 100, Nr. 10, Oktober 1967, S. 3368–3370, doi:10.1002/cber.19671001027.
- ↑ Christian Reus, Nai-Wei Liu, Michael Bolte, Hans-Wolfram Lerner, Matthias Wagner: Synthesis of Bromo-, Boryl-, and Stannyl-Functionalized 1,2-Bis(trimethylsilyl)benzenes via Diels–Alder or C–H Activation Reactions. In: The Journal of Organic Chemistry. Band 77, Nr. 7, 28. März 2012, S. 3518–3523, doi:10.1021/jo3002936.
- ↑ John R. Fritch, K. Peter C. Vollhardt, Michael R. Thompson, Victor W. Day: Apparent Concurrent Acetylene-Vinylidenecarbene Rearrangements, Silyl-Acetylide Metathesis, and Alkyne Cleavage in the Interaction of Bis(trimethylsilyl)acetylene with (η5-C5H5)Co(CO)2. Crystal and Molecular Structure of a Novel Biscarbyne Complex: [μ3η1-CSi(CH3)3][μ3η1-C3Si(CH3)3][(η5-C5H5)Co]3. In: Journal of the American Chemical Society. Band 101, Nr. 10, Mai 1979, S. 2768–2770, doi:10.1021/ja00504a065.
- ↑ U. Rosenthal: Reaktionen von Gruppe-4-Metallocen-Komplexen des Bis(trimethylsilyl)acetylens mit Nitrilen und Isonitrilen. In: Angewandte Chemie. 23. August 2018, doi:10.1002/ange.201805157.
- ↑ Jonathan R. Nitschke, Stefan Zürcher, T. Don Tilley: New Zirconocene-Coupling Route to Large, Functionalized Macrocycles. In: Journal of the American Chemical Society. Band 122, Nr. 42, Oktober 2000, S. 10345–10352, doi:10.1021/ja0020310.

