5-Azacytosin
5-Azacytosin ist ein Basenanalogon der Nukleinbase Cytosin, dessen CH-Gruppe in 5-Stellung durch ein Stickstoffatom ersetzt ist. Die durch Verknüpfung mit Pentosen entstehenden 5-Azacytidine wirken als Zytostatika.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
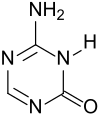
| Name | 5-Azacytosin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H4N4O | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 112,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,8010 (20 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung Bearbeiten
Ein älteres Patent[4] beschreibt die stark exotherme Reaktion zu 2-Amino-4-hydroxy-1,3,5-triazin durch Erhitzen von Dicyandiamid (DCD) „über kleiner Flamme“ mit 100%iger Ameisensäure. Dabei entsteht 5-Azacytosin als weißes Pulver, das bis 360 °C nicht schmilzt.
Erhitzt man DCD mit überschüssiger reiner Ameisensäure auf 80 °C, entwickelt sich eine exotherme Reaktion, bei der Amidinoharnstoff-formiat gebildet wird, das beim trockenen Erhitzen auf 150 °C zu 5-Azacytosin cyclisiert (Ausbeute 82 %).[5]
4-Amino-1,3,5-triazin-2-on ist auch schonender durch Reaktion von Guanylharnstoff-formiat mit Orthoameisensäuretriethylester oder Dimethylformamid-dimethylacetal als Cyclisierungsmittel in Dimethylformamid als Lösungsmittel in ca. 80%iger Ausbeute zugänglich.[6][7]
Eigenschaften Bearbeiten
5-Azacytosin ist ein weißes und geruchloses, wenig wasserlösliches Pulver, das zur Reinigung aus Wasser umkristallisiert werden kann. Wässrige Lösungen (0,7 g·cm−3) zeigen bei 28 °C einen pH-Wert von 5,9.[1] Die Verbindung liegt im Tautomerie-Gleichgewicht zwischen 4-Amino-1,3,5-triazin-2-on in der stabileren Amidform und 2-Amino-4-hydroxy-1,3,5-triazin vor.[8]
Anwendungen Bearbeiten
Von 5-Azacytosin leiten sich die synthetischen Nukleoside 5-Azacytidin (5-azaC) – INN Azacitidin – mit dem Zuckerrest β-D-Ribofuranose und 5-Aza-2′-deoxycitidin (5-azadC, Decitabin) mit dem Zuckerrest β-D-Desoxyribose ab.
In einer modernen Synthesevariante werden zunächst die reaktiven Amino- und Hydroxygruppe durch Silylierung mit Hexamethyldisilazan HMDS geschützt und das silylierte 5-Azacytosin mit der acetylgeschützten Ribose (1,2,3,5-Tetra-O-acetyl-β-D-ribofuranose) in Gegenwart von Trimethylsilyltrifluormethansulfonat (TMSOTf) zum geschützten 5-Azacytidin umgesetzt. Die Trimethylsilyl-Schutzgruppe wird bei der Aufarbeitung mit Natriumhydrogencarbonat abgespalten. Die Abspaltung der Acetylschutzgruppen erfolgt mit Natriummethanolat in Methanol (MeOH) zum rohen 5-Azacytosin, das mit DMSO/MeOH zum reinen Endprodukt (37 % Ausbeute) umkristallisiert wird.[9][10]
Beide Antimetaboliten hemmen das Enzym DNA-Methyltransferase, wodurch die Bildung von 5-Methyl-2′-deoxycytidin (m5dC) im Genom abnimmt, was wiederum epigenetisch stillgelegte Gene aktiviert.[11]
Das mit dem Zuckerrest β-D-Arabinose verknüpfte 5-Azacytosinderivat Fazarabine (1-β-D-Arabinofuranosyl-5-azacytosin, ara-AC) zeigte in Phase II der klinischen Prüfung zu geringe Wirksamkeit und wurde aufgegeben.[12]
Einzelnachweise Bearbeiten
- ↑ a b c d e f g Safety Data Sheet: 4-Amino-1,3,5-triazin-2-one. Alzchem, 21. Juli 2019, ehemals im (nicht mehr online verfügbar) am 31. Juli 2008; abgerufen am 22. Mai 2020. (Seite nicht mehr abrufbar. Suche in Webarchiven)
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 28.
- ↑ M. Krečmerová, M. Otmar: 5-azacytosine compounds in medicinal chemistry: current stage and future perspectives. In: Future Med. Chem. Band 4, Nr. 8, 2012, S. 991–1005, doi:10.4155/fmc.12.36.
- ↑ Patent DE861384: Verfahren zur Herstellung von 2-Amino-4-oxytriazin-(1,3,5). Veröffentlicht am 29. Oktober 1941, Anmelder: Deutsche Hydrierwerke A.G., Erfinder: C. Grundmann.
- ↑ R.C. Hartenstein, I. Fridovich: Amidinourea formate, a precursor of 2-amino-4-hydroxy-s-triazine. In: J. Org. Chem. Band 32, Nr. 5, 1967, S. 1653–1654, doi:10.1021/jo01280a095.
- ↑ A. Piskala: Nucleic acid components and their analogues. CI. Synthesis of 5-azacytosine (4-amino-1,2-dihydro-1,3,5-triazin-2-one) and its methyl derivatives. In: Collect. Czech. Chem. Commun. Band 32, Nr. 11, 1967, S. 3966–3976, doi:10.1135/cccc.19673966.
- ↑ Patent CS269077B1: Method of 5-azacytosine preparation. Angemeldet am 1. Oktober 1987, veröffentlicht am 11. April 1990, Anmelder: N.N., Erfinder: A. Piskalá, A. Cihák, L. Korbová.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur, 5. überarb. Aufl. Thieme, Stuttgart 2005, ISBN 3-13-541505-8, S. 641 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Patent US7858774B2: Synthesis of 5-azacytidine. Angemeldet am 10. September 2008, veröffentlicht am 28. Dezember 2010, Anmelder: Pharmion LLC, Erfinder: D. Ionescu, P. Blumbergs.
- ↑ S.K. Vujjini et al.: An improved and scalable process for the synthesis of 5-azacytidine: An antineoplastic drug. In: Org. Process Res. Dev. Band 17, Nr. 2, 2013, S. 303–306, doi:10.1021/op300192e.
- ↑ S. Schiffers, T.M. Wildenhof, K. Iwan, M. Stadlmeier, M. Müller, T. Carell: Label-free quantification of 5-azacytidines directly in the genome. In: Helvetica Chimica Acta. Band 102, Nr. 3, 2019, S. e1800229, doi:10.1002/hlca.201800229.
- ↑ J. Goffin, E. Eisenhauer: DNA methyltransferase inhibitors – state of the art. In: Ann. Oncol. Band 13, Nr. 11, 2002, S. 1699–1716, doi:10.1093/annonc/mdf314.