Walden-Umkehr
Als Walden-Umkehr (oder Waldensche Umkehr, manchmal auch Regenschirm-Mechanismus) bezeichnet man innerhalb einer ablaufenden chemischen Reaktion die Inversion (Änderung) der Konfiguration an einem stereochemischen Zentrum, meist einem Kohlenstoff-Atom. Benannt wurde der Mechanismus nach dem lettisch-deutschen Chemiker Paul Walden, der seine Entdeckung 1896 publizierte.[1]
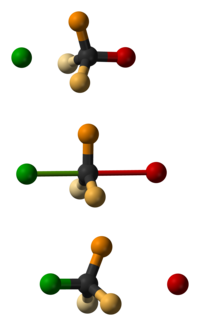
Entdeckung Bearbeiten
Paul Walden konnte ein Enantiomer einer chemischen Verbindung in das andere Enantiomer und wieder zurück in das ursprüngliche umwandeln, in einem Zyklus, der folgendermaßen ablief:
(+)-Chlorbernsteinsäure (1 im Bild) wurde durch Silberoxid in wässriger Lösung zu (+)-Äpfelsäure 2 umgewandelt, wobei die Konfiguration erhalten blieb. Im nächsten Schritt wurde die Hydroxylgruppe mit Chlor ersetzt, wodurch das andere Chlorbernsteinsäureenantiomer 3 durch Reaktion mit Phosphorpentachlorid erzeugt wurde. Eine Reaktion mit Silberoxid ergab (−)-Äpfelsäure 4 und schließlich brachte eine Reaktion mit Phosphorpentachlorid den Zyklus in die Ausgangsposition zurück.[1]
Im ersten Schritt fungiert das Silberoxid als Hydroxiddonator, das Silberion spielt für die Reaktion keine Rolle. Die Zwischenprodukte sind das Carboxyldianion A, das eine intramolekulare nucleophile Substitution mit dem β-Carboxylat-Anion eingeht, was zu einem viergliedrigen β-Lactonring B führt. Die α-Carboxylgruppe ist ebenfalls reaktiv, aber in-silico-Daten weisen darauf hin, dass die Übergangsenergie für die Bildung des dreigliedrigen α-Lactons sehr hoch ist. Ein Hydroxidion öffnet den Lactonring und bildet Alkohol C. Der Nettoeffekt von zwei Inversionen ist das Ausgangsenantiomer.[2]
Allgemeiner Reaktionsverlauf Bearbeiten
Während einer SN2-Reaktion geschehen konzertiert folgende Schritte: die Eintrittsgruppe nähert sich dem Zentralatom, die Abgangsgruppe entfernt sich vom Zentralatom und die drei nicht direkt an der Reaktion beteiligten Substituenten des Zentralatoms durchlaufen einen planaren Übergangszustand. Betrachtet man die Ein- und Austrittsgruppe mit, liegt ein trigonal-bipyramidaler Übergangszustand vor, bei dem Nukleophil und Abgangsgruppe sich in den axialen Positionen befinden. Ähnlich dem Umklappen eines Regenschirms ist die resultierende stereochemische Anordnung der Substituenten des Reaktionsprodukts eine andere als die des Ausgangsmaterials.
Ob mit der Änderung der Substituentenanordnung auch eine Änderung der absoluten stereochemischen Konfiguration einhergeht, ist von der Priorisierung der vier Reste nach dem Cahn-Ingold-Prelog-System abhängig. Nehmen Eintritts- und Abgangsgruppe die gleiche Priorität in der Rangfolge ein, so ändert sich der stereochemische Deskriptor, beispielsweise von (R)- zu (S)-.
Literatur Bearbeiten
- Peter Sykes: Reaktionsmechanismen der Organischen Chemie. 9. Auflage, Verlag Chemie 1979, ISBN 3-527-26872-3.
Einzelnachweise Bearbeiten
- ↑ a b P. Walden: Ueber die gegenseitige Umwandlung optischer Antipoden. In: Berichte der deutschen chemischen Gesellschaft. 29. Jahrgang, Nr. 1, 1896, S. 133–138, doi:10.1002/cber.18960290127 (zenodo.org).
- ↑ J. Grant Buchanan, Richard A. Diggle, Giuseppe D. Ruggiero, Ian H. Williams: The Walden cycle revisited: a computational study of competitive ring closure to α- and β-lactones. In: Chemical Communications. Nr. 10. Royal Society of Chemistry (RSC), 2006, doi:10.1039/b517461a.