Phagentherapie
Phagentherapie ist der therapeutische Gebrauch von Bakteriophagen zur Behandlung von krankheitsverursachenden bakteriellen Infektionen, insbesondere von antibiotikaresistenten Bakterienstämmen[1]. Phagen sind Viren, die auf Bakterien und Urbakterien als Wirtszellen spezialisiert sind und diese gezielt abtöten. Die Phagentherapie wurde in der Vergangenheit hauptsächlich in Ländern der früheren Sowjetunion, insbesondere Georgien, entwickelt und angewandt. Seit etwa den 1920er Jahren wurde sie dort vornehmlich bei gastroenteralen Infektionen wie Cholera und Shigellenruhr erfolgreich eingesetzt. In westlichen Ländern wurde sie bis in die 80er Jahre weiterverfolgt, z. B. in den neuen Bundesländern. In den letzten 10 Jahren wird sie als Alternative zu Antibiotika wiederentdeckt, die aufgrund der zunehmenden Antibiotikaresistenzen immer wirkungsloser werden. In Deutschland allein sterben jährlich 50.000 bis 60.000 Patienten an einer Sepsis. Für eine Vielzahl dieser Todesfälle sind antibiotikaresistente Bakterienstämme verantwortlich.

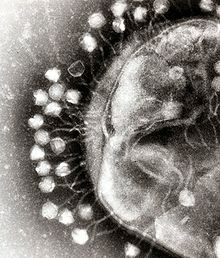
Phagentherapie wird, insbesondere in ihrem Mutterland Georgien, zur Behandlung aller bakteriellen Infektionen eingesetzt. In Deutschland kommt sie vornehmlich bei multiresistenten Bakterien zum Einsatz, die auf Antibiotika nicht mehr ansprechen.[2][3][4] Phagen sind tendenziell dort erfolgreicher als Antibiotika, wo Bakterien sogenannte Cluster bilden, die von einem Biofilm umhüllt sind, den Antibiotika typischerweise nicht durchdringen können.[5] Phagen sind aber dazu in der Lage und können dafür sorgen, dass Antibiotika das Bakterium wieder erreichen. Sie kommen daher in „adjuvanter Therapie“ besonders erfolgreich zur Anwendung.
Aufgrund der oben beschriebenen, spezifischen Wirkungsweise der Phagen erfolgt die Therapie über speziell hergestellte Phagenzubereitungen, sog. Rezepturarzneimittel, die innerhalb der EU zulassungsfrei hergestellt werden dürfen. Die Therapie selber ist in Deutschland aufgrund der generellen ärztlichen Therapiefreiheit – entgegen einer verbreiteten Behauptung – ebenfalls nicht zulassungspflichtig. Ärzte und Heilpraktiker dürfen daher speziell für den Patienten hergestellte, sogenannte named-patient-Zubereitungen in Deutschland uneingeschränkt verordnen. Aufgrund einer noch geringen Studienlage (Evidenz) haben sie dabei lediglich besondere Aufklärungspflichten zu beachten und müssen die Risiko-Nutzen-Abwägung, nach bestem Wissen, selbst vornehmen. Bakteriophagen sind nicht humanpathogen, sondern greifen nur das für sie spezifische Bakterium an. Es konnten in den über 500 bislang veröffentlichten Anwendungsstudien als Nebenwirkungen entzündungsspezifische Symptome wie Fieber festgestellt werden, welche jeweils vorübergehender Natur waren. Die herkömmlichen Antibiotika zeigen mitunter Nebenwirkungen an Leber und Niere und richten einen erheblichen Schaden am gesunden Mikrobiom des Menschen an, was wiederum zu einer weiteren Besiedelung mit multiresistenten, pathologischen Keimen führen kann. Bakteriophagen sind den chemischen Antibiotika daher in Bezug auf Spezifität, Effizienz und Nebenwirkungen überlegen.
In Ländern wie Georgien gehören Bakteriophagen daher zur Grundversorgung der Bevölkerung. Herkömmliche Antibiotika dürfen dort bei Schwangeren, stillenden Müttern und Kleinkindern erst dann eingesetzt werden, wenn Bakteriophagen nicht wirksam waren. In westlichen Ländern wird es derzeit noch umgekehrt gehandhabt.
Als Fertigarzneimittel für humanmedizinische Zwecke sind Phagenzubereitungen eher in den Ländern des ehemaligen Ostblocks verbreitet; innerhalb der EU gibt es – soweit ersichtlich – noch kein zugelassenes Fertigarzneimittel. Die Anwendung von Fertigarzneimitteln aus dem Ausland erfolgt daher derzeit noch im sogenannten Off-Label-Use und im Rahmen einer Notfall-Indikation. Als relativ unspezifisches Breitband-Antibiotikum ist ihr Wirkungsspektrum gegen im Westen verbreitete Bakterienstämme zum Teil sogar erstaunlich erfolgreich.
Die Phagentherapie ist in Deutschland also erlaubt; es fehlt lediglich an einer entsprechenden Infrastruktur.
Geschichte Bearbeiten
Nach der Entdeckung der Bakteriophagen durch Frederick Twort und Felix d’Hérelle[6] 1915 und 1917 wurde die Phagentherapie von vielen Wissenschaftlern sofort als ein entscheidender Fortschritt bei der Bekämpfung von Infektionskrankheiten erkannt. Georgi Eliava, ein Georgier, machte ähnliche Entdeckungen. Er reiste zum Institut Pasteur in Paris und traf dort d’Hérelle. 1923 gründete er das Eliava-Institut für Phagenforschung in Tiflis.
In den Nachbarländern, u. a. in Russland, begann bald darauf ausgedehnte Forschungs- und Entwicklungstätigkeit. In den USA begann in den 1940er Jahren das Pharmaunternehmen Eli Lilly and Company, die Phagentherapie als kommerzielles Produkt anzubieten.
Während so Wissen über die Biologie der Phagen und über die richtige Anwendung der Cocktails gesammelt wurde, waren die frühen Anwendungen der Phagentherapie oft unzuverlässig. Als 1941 die Antibiotika entdeckt und in den USA und Europa breit vermarktet wurden, verloren die meisten westlichen Wissenschaftler das Interesse daran, die Phagentherapie weiterzuentwickeln.[7]
Von den westlichen Fortschritten in der Antibiotikaherstellung der 1940er Jahre abgeschnitten, entwickelten russische Wissenschaftler die bereits erfolgreiche Phagentherapie weiter, um die Wunden von Soldaten in Feldlazaretten zu behandeln. Während des Zweiten Weltkrieges wurden in der Sowjetunion viele Soldaten mit Phagen behandelt, die an verschiedenen bakteriell verursachten Krankheiten wie Dysenterie oder Gangränen litten. Die Erfolgsquote war, verglichen mit der jedes Antibiotikums, ebenso gut, wenn nicht besser. Russische Forscher entwickelten und verfeinerten ihre Behandlungsmethoden weiter und publizierten darüber. Wegen der Barrieren, die der Kalte Krieg der Wissenschaft entgegensetzte, wurde dieses Wissen jedoch nicht übersetzt und konnte nicht weltweit verbreitet werden.[8][9] Eine Zusammenfassung dieser Veröffentlichungen ist 2011 auf Englisch erschienen: A Literature Review of the Practical Application of Bacteriophage Research.[10]
Am Eliava-Institut in Tiflis gibt es eine umfangreiche Bibliothek und ein Forschungszentrum. Phagentherapie ist heute in dieser Region eine weitverbreitete Behandlungsform. Seit 1930 behandeln georgische Ärzte einheimische Patienten mit Phagen, darunter auch Säuglinge und Neugeborene.
Infolge der Entwicklung von Antibiotikaresistenzen seit den 1950er Jahren und eines fortgeschrittenen Kenntnisstandes ist weltweit ein neues Interesse für die Möglichkeit erwacht, Phagentherapie zusammen mit anderen Strategien zur Auslöschung von bakteriellen Infektionen und chronischen polymikrobiellen Biofilmen einzusetzen.
Phagen wurden als ein mögliches Mittel untersucht, um Krankheitserreger wie Campylobacter in roher Nahrung[11] und Listerien in frischen Lebensmitteln zu vernichten oder um Bakterien zu bekämpfen, die Lebensmittel verderben lassen.[12] In der landwirtschaftlichen Praxis wurden Phagen benutzt, um pathogene Keime wie Campylobacter, Escherichia und Salmonellen bei Nutztieren zu bekämpfen, Lactococcus und Vibrionen bei Fischen in Aquakultur und Erwinia und Xanthomonas bei Nutzpflanzen. Das älteste Einsatzgebiet war allerdings die Humanmedizin. Phagen wurden gegen Durchfallerkrankungen eingesetzt, die von Escherichia coli, Shigella und Vibrio verursacht werden, sowie gegen Wundinfektionen durch fakultative Pathogene wie Staphylokokken oder Streptokokken. Neuerdings wurde der phagentherapeutische Ansatz auf systemische und sogar intrazelluläre Infektionen angewandt und nicht-replizierende Phagen und isolierte Phagenenzyme wie Lysine sind dem Arsenal der antimikrobiellen Mittel hinzugefügt worden. Allerdings stehen keine tatsächlichen Nachweise für die Wirksamkeit dieser Phagenanwendungen im Feld und in der Klinik zur Verfügung.
Das Interesse des Westens kann zum Teil auf das Jahr 1994 zurückgeführt werden, als Soothill am Tiermodell demonstrierte, dass Phagen die Erfolgsquote von Hauttransplantationen erhöhen können, indem sie die darunterliegende Infektion mit Pseudomonas aeruginosa reduzieren.[13] Neuere Studien haben diese Befunde im Modellsystem zusätzlich untermauert.[14]
Auch wenn es keine „Phagentherapie“ im ursprünglichen Sinn ist, stellt die Nutzung von Phagen als Transporter für herkömmliche Antibiotika eine andere mögliche therapeutische Anwendung dar.[15][16] Auch der Gebrauch von Phagen zum Transport von Antitumor-Wirkstoffen bei Voruntersuchungen an Zellen in Gewebekulturen ist beschrieben worden.[17]
Aktuelle und mögliche Anwendungsgebiete Bearbeiten
Medizinische Phagentherapie Bearbeiten
Die Behandlung mit Bakteriophagen ist bei bakteriellen Infektionen eine mögliche Alternative oder Ergänzung zu konventionellen Antibiotikatherapien.[18]
Bakteriophagen wirken spezifisch, denn sie greifen nur einen oder wenige Bakterienstämme an.[19] Traditionelle Antibiotika sind demgegenüber wesentlich unspezifischer und töten sowohl krankheitserregende Bakterien ab als auch wichtige, harmlose Bakterien, wie die Mikrobiota der Darmflora. Phagen wirken – anders als chemische Antibiotika – auch gegen antibiotikaresistente Bakterien. Es gibt eine ganze Reihe aktueller Veröffentlichungen, die die Wirksamkeit von Phagen belegen.[20]
Das in der Phagentherapie seit langem tätige Eliava-Institut in Tiflis meldet Erfolgsraten zwischen 67 % bei Lungeninfektionen und bis zu 100 % bei Entzündungen des Knochenmarks (Osteomyelitis).[21]
Einige Studien zeigen, dass Phagen imstande sind, gezielt an einen bestimmten Ort zu wandern – etwa durch die Blut-Hirn-Schranke zum Gehirn – und sich dort mittels eines geeigneten bakteriellen Wirts zu vermehren. Dieser Mechanismus zeigte sich in einer Behandlung von Gehirnhautentzündung Meningitis bei einem Neugeborenen als wirksam.[22] Weitere Veröffentlichungen gibt es zu Pseudomonas aeruginosa,[23] Klebsiella, Shigella, Staphylokokken, Streptokokken, Escherichia coli, Proteus, Salmonella[24] und anderen Keimen. Labortests zeigten, dass Bakterien durch intraperitoneal, intravenös oder intranasal zugeführte Phagen abgetötet werden können.[25] In der septischen Chirurgie, in der Herzchirurgie und in der Transplantationschirurgie kommen sie topisch zum Einsatz, in der Lungenheilkunde durch Inhalation etc.
Einige Pharmaunternehmen entwickeln aktuell (2014) Phagenenzyme, wie z. B. ein Endolysin gegen den methicillinresistenten Staphylococcus aureus (MRSA).[26] Sie könnten in Form imprägnierter Wundverbände zur vorbeugenden Behandlung von Verbrennungsopfern, sowie phagenimprägnierter Wundnahtmittel zur Anwendung kommen.[27]
Enzobiotics sind eine Entwicklung der Rockefeller University, bei der Enzyme aus Phagen hergestellt werden. Diese vermögen sekundären Infektionen mit Bakterien vorzubeugen, wie sie etwa bei Patienten mit Grippe auftreten können, z. B. als Lungenentzündung oder Mittelohrentzündung. Gereinigte Enzyme rekombinanter Phagen lassen sich als eigenständige antibakterielle Wirkstoffe verwenden.[28]
Die Arbeitsgruppe um Paul E. Turner sucht gezielt nach Phagen, die dem Resistenzmechanismus gegen Antibiotika von Pseudomonas aeruginosa entgegenwirken.[29] In den USA konnte eine Infektion mit Pseudomonas aeruginosa mit einer Phagentherapie erfolgreich behandelt werden.[30]
An der Kinderklinik des Universitätsklinikums Hamburg-Eppendorf haben Ärzte im Jahr 2021 das Leben eines einjährigen Kleinkinds mit Bakteriophagen gerettet, das bei einer Lebertransplantation mit einem antibiotikaresistenten Enterococcus faecum infiziert wurde.[31] Da das UKE damals noch nicht über ein eigenes Phagenlabor verfügte, hat das Institut für Mikrobiologie am Queen-Astrid-Military-Hospital (QAMH) in Brüssel geholfen, einen passenden Phagen zu finden, hat die Phagenzubereitung hergestellt und der Klinik kostenlos zur Verfügung gestellt.
Rebekah M. Dedrick und Kollegen berichteten 2019 von der erfolgreichen Behandlung einer 15-jährigen Patientin mit teilweise gentechnisch aggressiver gemachten Phagen („Muddy“, „ZoeJ“ und „BPs“, alle Siphoviren), bei der andere Therapien zuvor versagt hatten;[32][33] dies wurde mehrfach in deutschen Medien aufgegriffen.[34][35]
Im Jahr 2013 wurde das von der EU finanzierte Projekt Phagoburn gestartet, bei dem die Wirksamkeit von Phagen bei Brandwunden im Vergleich zur herkömmlichen Behandlung mit Silbernitrat getestet werden sollte.[36] Das Ergebnis war, dass die Silbernitratlösung bessere Ergebnisse hatte. Allerdings wurde Kritik an der Zusammensetzung der Studienkohorte geäußert. Die Studie ist möglicherweise ein Beispiel dafür, dass Bakterien sich aufgrund ihrer Neigung, sich zu verändern, für klinische Studien nicht gut eignen.
Phagen wirken spezifisch auf jeweils bestimmte Wirtsarten. Es ist daher notwendig, einen Abstrich vom Patienten zu machen und davon eine Bakterienkultur anzulegen, bevor die Behandlung beginnen kann. Anhand dieser Bakterienkultur wird dann ein spezieller Phagencocktail gemischt. In einem Phagencocktail befinden sich dann immer mindestens drei vorher genau bestimmte Phagen, die gegen die zu bekämpfenden Bakterien wirken. Phagencocktails sind also keine Fertigarzneimittel, sondern Rezepturarzneimittel, die nicht dem AMG unterfallen und daher auch keine Zulassung benötigen.
In der Praxis werden Phagen örtlich auf infizierte Wunden oder auf Oberflächen aufgetragen, durch Infusionen zugeführt, oral eingenommen oder sie werden während chirurgischer Eingriffe verwendet. Zur örtlichen Anwendung werden die Phagen oft auf Gaze aufgebracht, die auf die zu behandelnde Stelle gelegt wird.
Die Phagentherapie ist bei einer Vielzahl von bakteriellen Infektionen erprobt worden, darunter Laryngitis, Hautinfektionen, Dysenterie, Konjunktivitis, Parodontitis, Gingivitis, Sinusitis, bakterielle Prostatitis,[37] Harnwegs- und Darminfekte, Verbrennungen, Verbrühungen, poly-mikrobielle Biofilme auf chronischen Wunden, Ulcus und infizierte Operationswunden. Seit über 30 Jahren ist zudem bekannt, dass auch gegen Mykobakterien wie Mycobacterium tuberculosis spezifische Bakteriophagen existieren.[38][39] Allein gegen das besonders toxische Clostridium difficile, das für viele nosokomiale Infektionen verantwortlich ist, ist bisher kein lytischer Phage entdeckt worden. Aber es sind einige temperente (d. h. im Genom integrierte) Phagen für diese Spezies bekannt, wodurch sich vielversprechende Wege öffnen.
Forschung Bearbeiten
In der westlichen Welt werden inzwischen erhebliche Summen in die Forschung an Phagen investiert, ohne dass die medizinische Praxis davon profitiert, so auch in Deutschland. Die Anzahl der Forschungsprojekte in Deutschland, die sich mit Bakteriophagen beschäftigen, ist recht unübersichtlich geworden.[40]
2007 wurde an der königlichen Londoner Hals-, Nasen- und Ohrenklinik eine klinische Studie an Gehörgangsinfektionen (Otitis) mit Pseudomonas aeruginosa fertiggestellt.[41][42][43] Eine Dokumentation der Phase-1/Phase-2-Studie wurde August 2008 in der Zeitschrift Clinical Otolaryngology veröffentlicht.[44]
Klinische Tests der Phase 1 sind 2009 am Southwest Regional Wound Care Center in Lubbock in Texas mit einem zugelassenen Cocktail antibakterieller Phagen durchgeführt worden. Dieser wirkt u. a. gegen Pseudomonas aeruginosa, Staphylococcus aureus und Escherichia coli.[45] Der Phagencocktail wurde von der Firma Intralytix in Baltimore in Maryland produziert und zur Verfügung gestellt. 2019 wird berichtet, dass eine Patientin in London erfolgreich behandelt wurde, die mit einem multiresistenten Bakterium infiziert war. Das Great Ormond Street Hospital arbeitete mit der University of Pittsburgh zusammen. Wirksame Phagen wurden identifiziert, mussten zur Erhöhung der Wirksamkeit aber außerdem genetisch verändert werden; die Patientin sei fast vollständig genesen.[46]
Ein bedeutendes Forschungszentrum hat sich am Westmead-Institut der Universität Sydney etabliert.[47]
Wegen der Spezifität der Phagen wäre die Phagentherapie mit einem Cocktail als Fertigarzneimittel naheliegend, was aber von der amerikanischen Lebensmittel- und Medikamentenbehörde FDA noch abgelehnt wird. Dort ist jeder Therapieansatz genehmigungspflichtig, allerdings genehmigt die FDA die Therapie in der Regel, und zwar binnen 24 Std. nach Antragseingang in Eilfällen. Forscher und Beobachter weisen darauf hin, dass die FDA ihren Standpunkt bezüglich Medikamentencocktails ändern muss, damit die Phagentherapie einer breiteren Öffentlichkeit zur Verfügung gestellt werden und zum Erfolg gegen die weltweite Bedrohung der Bevölkerung durch Sepsis führen kann.[48] Das Wissen über die Phagentherapie ist derzeit noch auf die in der Forschung Tätigen begrenzt und in den medizinischen Medien eher nicht zu finden.[49] Es wäre sehr wünschenswert, wenn auch die Behörden sich der Phagentherapie öffnen würden.[50]
Therapeutische Wirksamkeit Bearbeiten
Das George Eliava-Institut in Tiflis sammelt seit 100 Jahren Bakteriophagen und führt Phagentherapie durch. Je nach Bakterieninfektion seien Phagencocktails mit einer therapeutischen Wirksamkeit bis zu 100 % erreicht worden.[51]
Auch das Ludwik Hirszfeld Institute in Wrocław, benannt nach Ludwik Hirszfeld, bietet die Phagentherapie an. Über die therapeutische Wirksamkeit gibt es ebenso wie aus Tiflis sehr viele Veröffentlichungen.[52]
In Russland sollen gemischte Phagenzubereitungen eine therapeutische Wirksamkeit von 50 % gezeigt haben.[53]
In Frankreich werden seit 2017 am Centre de Référence des Infections Ostéo-articulaires Complexes (CRIOAc) in Lyon[54] unter der Leitung des Chirurgen Tristan FERRY Patienten, die zuvor wegen resistenter osteoartikulärer Infektionen (Knochen- und Gelenkentzündungen) nicht geheilt werden konnten, erfolgreich mit Phagen behandelt. Durch Tests an den Bakterien der Patienten hat das französische Biotechnologie-Unternehmen Pherecydes Pharma die zur Bekämpfung geeignetsten Bakteriophagen für eine maßgeschneiderte Behandlung ausgewählt. Da eine Phagenbehandlung in Frankreich offiziell nicht zugelassen ist, erhielten die wirksamen Phagen von den Behörden eine befristete Zulassung für eine Studien-Anwendung und im Rahmen eines Compassionate Use, die sehr erfolgreich ist.[55][56][57]
Sicherheit Bearbeiten
Probleme bei der Phagentherapie können vor allem sog. Superspreader darstellen.[58] Das sind sog. „lysogene“ Phagen, die einen ausgeprägten horizontalen Genaustausch mit dem Bakterium vornehmen können. Das Bakterium wird dabei nicht abgetötet, sondern die Phagen können Resistenz-Gene der Bakterien aufnehmen und an andere Bakterien weitergeben. Diese lysogenen Phagen werden bei der Isolierung der Phagen aber durch Genomsequenzierung identifiziert und ausgesondert. Diese unerwünschte Eigenschaft ist daher in der Humanmedizin weniger problematisch. Problematischer ist sie wiederum durch weniger sorgfältige Aussonderung und anschließende, großflächige Ausbringung in der Agrar- und Lebensmittelindustrie. In den Ställen werden heute durch Antibiotikamissbrauch eine unüberschaubare Anzahl neuer Resistenzgene gezüchtet. Diese können durch Superspreader wiederum gut verteilt und erhalten werden.
Wie auch bei Antibiotikabehandlung und anderen Methoden gegen bakterielle Infektionen setzen Bakterien bei ihrer Zerstörung im Körper Endotoxine frei. Das kann Fiebersymptome hervorrufen. In extremen Fällen ist ein toxisches Schocksyndrom möglich (Jarisch-Herxheimer-Reaktion), ein Risiko, das allerdings auch beim Einsatz chemischer Antibiotika bekannt ist.[59] Dem kann aber durch früheren Therapiebeginn, vorsichtigere Dosierung und gezielte Gegenmaßnahmen begegnet werden.
Ein anderer Weg, diese Komplikation zu vermeiden, ist von Janakiraman Ramachandran vorgeschlagen worden, früher bei AstraZeneca India, wo er GangaGen, ein Phagentherapie-Startup in Bangladesch gründete: Bei jenen Infektionstypen, bei denen diese Reaktion wahrscheinlich ist, könnte man gentechnisch veränderte Bakteriophagen einsetzen, bei denen das Gen zur Erzeugung von Endolysin entfernt ist. Ohne dieses Gen stirbt das Wirtsbakterium zwar auch, aber da keine Lyse stattfindet, bleibt seine Hülle intakt. Diese Modifikation verhindert allerdings auch die exponentielle Vermehrung der Phagen, sodass der Heilungsprozess verlangsamt stattfindet und wesentlich mehr Phagenlysat benötigt wird.[4] Diese toten Zellen werden schließlich im Verlauf der normalen „Hausputz-Tätigkeit“ der Phagozyten vernichtet, die das Bakterium einschließlich seines Inneren durch Enzyme in harmlose Proteine, Polysaccharide und Lipide zerlegen.[60]
Temperente Bakteriophagen werden normalerweise nicht therapeutisch verwendet, da manche dieser Phagen auch Bakterien-DNA von einer Wirtszelle zur nächsten übertragen, wodurch sich Antibiotikaresistenzen weiterverbreiten und Bakterien theoretisch sogar pathogen werden können (siehe Cholera).
Phageneinsatz in der Tiermedizin Bearbeiten
Auch in der Tiermedizin kommt die Phagentherapie zum Einsatz:
Im Tiergarten Nürnberg hat die Behandlung mit einem Phagencocktail aus Tiflis ein Panzernashorn davor bewahrt, eingeschläfert zu werden.[61] Wertvolle Turnierpferde, die sich eine bakterielle Infektion mit multiresistenten Keimen zugezogen haben, können mit der Phagentherapie billig, schnell und gezielt geheilt werden.
Phageneinsatz in der Lebensmittelindustrie Bearbeiten
Die US-amerikanische FDA hat im August 2006 das Einsprühen von Fleisch mit Phagen zugelassen. Die Zulassung wurde für das Präparat ListShield des Herstellers Intralytix erteilt, eine Phagenzubereitung, die gegen Listeria monocytogenes wirkt. Es war die erste Zulassung eines auf Phagen basierenden Lebensmittel-Additivs durch die FDA und USDA. Dies löste zwar zunächst Besorgnis aus, weil ohne Kennzeichnungspflicht dem Verbraucher nicht bewusst sein wird, dass Fleisch- und Geflügelprodukte mit dem Mittel behandelt wurden.[62] Es bestätigt jedoch gegenüber der Öffentlichkeit, dass Phagen gegen Listerien in der weltweiten wissenschaftlichen Gemeinschaft als ungefährlich gelten (Zulassung als Generally Recognized As Safe), und es öffnet den Weg dafür, auch anderen Phagen die GRAS-Zulassung zu ermöglichen.
Zudem werden Phagen zur Bekämpfung von Listerien und Salmonellen in Lebensmitteln eingesetzt, um Lebensmittelvergiftungen vorzubeugen.[63][64]
Phagen werden schon lange für den Einsatz gegen schädliche Bakterien im Obst- und Gemüseanbau diskutiert. So gibt es Veröffentlichungen über den Einsatz gegen Erwinia amylovora, Pseudomonas, Xanthomonas, Streptomyces, Pectobacterium carotovorum, Xylella fastidiosa, Ralstonia solanacearum und Dickeya solani.[65]
An der Brigham Young University erforscht man die Nutzung der Phagentherapie zur Behandlung der Amerikanischen Faulbrut bei Bienen.[66][67]
Technische Aspekte Bearbeiten
Gewinnung der Phagen Bearbeiten
Das Grundprinzip der Phagengewinnung ist, an dem Ort Proben zu entnehmen, wo wahrscheinlich eine große Zahl der entsprechenden Bakterien zu finden ist.[2] Proben können aus Abwasser, in Flüssen, in Seen oder auch aus Erde gewonnen werden. Die entnommenen Proben werden auf die gesuchten Phagen hin untersucht. Hierfür wird die wässerige Lösung sterilfiltriert. Da Phagen sehr viel kleiner sind als Bakterien, verbleiben die Bakterien im Filter und die Phagen gehen in Lösung. Daraufhin kann man die Mixtur aus Partikeln, die kleiner als 0,45 µm sind, untersuchen. Dies geschieht auf einem entsprechenden Nährmedium, auf dem die zu untersuchenden Bakterien kultiviert worden sind. Passende Phagen bilden auf dem Bakterienrasen Plaques, die durch die abgestorbenen Bakterien entstehen. Daraufhin kann man die Phagen anreichern und untersuchen.
Bei der Untersuchung der Phagen ist eine gute Herstellungspraxis wichtig. Das heißt, dass am Ende nur ein einziger, genau bestimmter Phage steht. Dieser Phage wird dann für die Herstellung eines Phagencocktails mit anderen Phagen gemischt.
Ebenfalls wegen ihrer hohen Spezifität wird oft eine Mixtur von Phagen angewandt, um eine hohe Erfolgswahrscheinlichkeit zu erzielen. Das bedeutet, dass Phagenbänke unterhalten und regelmäßig mit neuen Phagen aufgefrischt werden müssen.
Stabilität von Phagen und Phagenzubereitungen Bearbeiten
Die Stabilität von Phagen bei Lagerung und Transport sind phagenspezifisch verschieden. Es gibt verschiedene Familien von Bakteriophagen und ihre Empfindlichkeit gegenüber externen Faktoren wie etwa Temperatur, Säureeinwirkung, Salzkonzentration und UV-Strahlung ist sehr unterschiedlich.[68]
Einige Phagen müssen kühl aufbewahrt werden,[69] andere hingegen nicht.[70]
Bei allen Phagen ist der pH-Wert bedeutsam für die Stabilität. Mit Pufferlösungen kann er stabil eingestellt werden. Manche Phagen können gefriergetrocknet und zu oralen Arzneiformen verarbeitet werden, ohne dass die Wirksamkeit nennenswert beeinträchtigt wird.
Gentransfer Bearbeiten
Es ist schon mindestens seit 1962 bekannt, dass Phagen Gene horizontal austauschen können.[71] So gibt es auch heute immer wieder wissenschaftliche Berichte, dass Phagen auch Antibiotikaresistenzen von einem Bakterium auf ein anderes übertragen können.[72] Auch gibt es Berichte über sogenannte „Superspreader“, dies sind Phagen, die den horizontalen Genaustausch sehr umfangreich betreiben.[73] Solche Superspreaders sollten bei einer Phagentherapie unbedingt vermieden werden. Deshalb fordern heute viele Wissenschaftler eine gute Herstellungspraxis für Phagencocktails. Des Weiteren ist in Hinblick auf diesen Aspekt der Einsatz von Phagen in der Agrar- und Lebensmittelindustrie kritisch zu betrachten.
Eine Forschergruppe vom Weizmann-Institut konnte zeigen, dass spezielle Phagen, die Bacillus befallen, mit einem kleinen Peptid über 6 Aminosäuren zwischen dem lysogenen und lytischen Zyklus umschalten können. Die Forschergruppe benannte die Art der Kommunikation mit Arbitrium-System.[74] Dies bedeutet, dass Phagen in zwei Formen mit den Bakterien interagieren. Entweder bringen sie den Wirt zum Platzen oder dringen ein und integrieren sich in das Genom des Wirtes und warten ab. Für eine Phagentherapie müsste man sicherstellen, dass nicht zuerst der lysogene Zyklus eintritt.
Phagenbänke Bearbeiten
Durch die Notwendigkeit, Phagenbänke zu unterhalten, werden behördlich vorgeschriebene Sicherheitstests schwieriger und teurer. Es würde dadurch schwierig, phagentherapeutische Produkte in großem Umfang herzustellen. Auch patentrechtliche Fragen (besonders, was lebende Organismen betrifft) könnten den Vertrieb für solche Firmen erschweren, die exklusive Rechte an ihrer „Erfindung“ haben möchten.
Resistenz gegen Phagen Bearbeiten
Wie bei Antibiotika können Bakterien gegen die Behandlungen resistent werden. In diesem Fall überleben sie durch Mutationen den Angriff der Phagen. Allerdings bringt die Evolution rasch neue Phagentypen hervor, die die resistent gewordenen Bakterien zerstören können. Zudem büßen gegen Phagen resistent gewordene Bakterien oftmals stark ihre Virulenz ein oder verlieren in diesem Prozess anderweitig teilweise oder vollständig ihre Gefährlichkeit für Menschen oder Tiere. Dies begründet sich aus den Umbauprozessen der bakteriellen Hülle als Abwehrmaßnahme bei der Resistenzentwicklung gegen Phagen, die u. a. dazu führen können, dass das menschliche Abwehrsystem die Bakterien besser erkennen und/oder angreifen kann. Phagen werden, wenn man sie in die Blutbahn injiziert, vom menschlichen Immunsystem erkannt. Einige davon werden rasch ausgeschieden, und nach einer gewissen Zeitspanne werden Antikörper gegen die Phagen produziert. Es scheint, als ob man aus diesem Grund einen bestimmten Phagen nur einmal zur intravenösen Behandlung verwenden kann.[75]
Siehe auch Bearbeiten
Literatur Bearbeiten
- Karin Mölling: Kampf den Keimen – Mit Viren aus der Antibiotika-Krise. 1. Auflage, Pfeil-Verlag, München 2020, ISBN 978-3-89937-265-6.
- Thomas Häusler: Gesund durch Viren – Ein Ausweg aus der Antibiotika-Krise. Piper, München/ Zürich 2003, ISBN 3-492-04520-0 (Buchbesprechung im Laborjournal).
- Inger Völkel, Claus-Peter Czerny: Phagentherapie in der Tiermedizin: Ein Überblick. In: Berliner und Münchener tierärztliche Wochenschrift. Nr. 124, 11. Juli 2011, S. 303–312.
- Diana D. Semler, Karlene H. Lynch, Jonathan J. Dennis: The promise of bacteriophage therapy for Burkholderia cepacia complex respiratory infections. In: Frontiers in Cellular and Infection Microbiology. Nr. 1, 2012, doi:10.3389/fcimb.2011.00027.
- Lauren Gravitz: Turning a new phage. In: Nature Medicine. Band 18, Nr. 9, September 2012, S. 1318–1320, doi:10.1038/nm0912-1318, PMID 22961150 (Review).
- Thomas Häusler, Christian Kühn: Bakteriophagen. Wenn Antibiotika nicht mehr helfen – mit Viren gegen multiresistente Keime. Wirkung und Therapie. 1. Auflage, Südwest Verlag, München 2022, ISBN 978-3-517-10043-2.
- Enea Maffei, Anne-Kathrin Woischnig, Marco R. Burkolter, Yannik Heyer, Dorentina Humolli, Nicole Thürkauf, Thomas Bock, Alexander Schmidt, Pablo Manfredi, Adrian Egli, Nina Khanna, Urs Jenal, Alexander Harms: Phage Paride can kill dormant, antibiotic-tolerant cells of Pseudomonas aeruginosa by direct lytic replication. In: Nature Communications. Band 15, Nr. 175, 2. Januar 2024; doi:10.1038/s41467-023-44157-3 (englisch). Dazu:
- David Nield: Virus That Murders Sleeping Bacteria Could Be Used to Assassinate Superbugs. Auf: sciencealert.com vom 30. Januar 2024.
- Martin Vieweg: „Bakterien-Fresser“ mit Potenzial entdeckt. Auf: wissenschaft.de vom 22. Januar 2024.
Weblinks Bearbeiten
- Entwicklung von Bakteriophagen als zugelassenes Medikament gegen bakterielle Infektionen. Auf: phage4cure.de; abgerufen am 13. Juli 2020.
- Theodor Dingermann, Ilse Zündorf: Biologische Waffen gegen Bakterien. In: Pharmazeutische Zeitung. Ausgabe 35/2016.
- Bernd Kramer: Mit Viren auf Bakterienjagd, Zeit online, 2. Juli 2019.
- Fabian Federl, Yannic Hannebohn: Heilung aus der Natur. In: The Cure – Heilung aus dem Grab. Folge 6, Podcast. Auf: deutschlandfunkkultur.de, 29. August 2022.
- Cornelia Birr: Multiresistente Keime bekämpfen: Phagentherapie mit Bakterienfressern. Auf: mdr.de vom 6. Juli 2023.
Einzelnachweise Bearbeiten
- ↑ mdr.de: Multiresistente Keime bekämpfen: Phagentherapie mit Bakterienfressern | MDR.DE. Abgerufen am 10. Januar 2024.
- ↑ a b Phage – The Virus that Cures. BBC Horizon, 9. Oktober 1997; archive.org im Videoarchiv – Internet Archive (Video, 49 min.).
- ↑ T. Parfitt: Georgia: an unlikely stronghold for bacteriophage therapy. In: The Lancet. Band 365, Nr. 9478, 2005, S. 2166–2167, doi:10.1016/S0140-6736(05)66759-1, PMID 15986542.
- ↑ a b Karl Thiel: Old dogma, new tricks – 21st Century phage therapy. In: Nature Biotechnology. Band 22, Nr. 1. London UK Januar 2004, S. 31–36, doi:10.1038/nbt0104-31, PMID 14704699 (nature.com [abgerufen am 15. Dezember 2007]).
- ↑ Maria Aguita: Combating Bacterial Infection. In: LabNews.co.uk. Abgerufen am 5. Mai 2009.
- ↑ S. M. Shasha, N. Sharon, M. Inbar: Bacteriophages as antibacterial agents. In: Harefuah. Band 143, Nr. 2, 2004, S. 121–125, 166, PMID 15143702 (hebräisch).
- ↑ G. W. Hanlon: Bacteriophages: an appraisal of their role in the treatment of bacterial infections. In: International Journal of Antimicrobial Agents. Band 30, Nr. 2, 2007, S. 118–28, doi:10.1016/j.ijantimicag.2007.04.006, PMID 17566713.
- ↑ Stalin’s Forgotten Cure. In: Science. Band 298, 25. Oktober 2002, S. 728–731. (PDF; 285 kB) (Memento des vom 25. Juni 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF)
- ↑ W. C. Summers: Bacteriophage therapy. In: Annual Review of Microbiology. Band 55, 2001, S. 437–451, doi:10.1146/annurev.micro.55.1.437, PMID 11544363.
- ↑ Nina Chanishvili: A Literature Review of the Practical Application of Bacteriophage Research. Nova Science, New York 2011, ISBN 978-1-62100-851-4.
- ↑ M. J. Mangen, A. H. Havelaar, K. P. Poppe, G. A. de Wit: Cost-utility analysis to control Campylobacter on chicken meat: dealing with data limitations. In: Risk Analysis. Band 27, Nr. 4, 2007, S. 815–830, doi:10.1111/j.1539-6924.2007.00925.x, PMID 17958494.
- ↑ S. Mc Grath, D. van Sinderen (Hrsg.): Bacteriophage: Genetics and Molecular Biology. 1. Auflage. Caister Academic Press, 2007, ISBN 978-1-904455-14-1 (horizonpress.com).
- ↑ J. S. Soothill: Bacteriophage prevents destruction of skin grafts by Pseudomonas aeruginosa. In: Burns. Band 20, Nr. 3, 1994, S. 209–211, doi:10.1016/0305-4179(94)90184-8, PMID 8054131.
- ↑ C. S. McVay, M. Velásquez, J. A. Fralick: Phage therapy of Pseudomonas aeruginosa infection in a mouse burn wound model. In: Antimicrobial Agents and Chemotherapy. Band 51, Nr. 6, 2007, S. 1934–1938, doi:10.1128/AAC.01028-06, PMID 17387151, PMC 1891379 (freier Volltext).
- ↑ I. Yacoby, H. Bar, I. Benhar: Targeted drug-carrying bacteriophages as antibacterial nanomedicines. In: Antimicrob. Agents Chemother. Band 51, Nr. 6, 2007, S. 2156–2163, doi:10.1128/AAC.00163-07, PMID 17404004, PMC 1891362 (freier Volltext).
- ↑ I. Yacoby, M. Shamis, H. Bar, D. Shabat, I. Benhar: Targeting antibacterial agents by using drug-carrying filamentous bacteriophages. In: Antimicrob. Agents Chemother. Band 50, Nr. 6, 2006, S. 2087–2097, doi:10.1128/AAC.00169-06, PMID 16723570, PMC 1479106 (freier Volltext).
- ↑ H. Bar, I. Yacoby, I. Benhar: Killing cancer cells by targeted drug-carrying phage nanomedicines. In: BMC Biotechnol. Band 8, 2008, S. 37, doi:10.1186/1472-6750-8-37, PMID 18387177, PMC 2323368 (freier Volltext) – (biomedcentral.com).
- ↑ A. Górski, R. Miedzybrodzki, J. Borysowski, B. Weber-Dabrowska, M. Lobocka, W. Fortuna, S. Letkiewicz, M. Zimecki, G. Filby: Bacteriophage therapy for the treatment of infections. In: Current Opinion in Investigational Drugs. Band 10, Nr. 8, August 2009, S. 766–74, PMID 19649921.
- ↑ D. H. Duckworth, P. A. Gulig: Bacteriophages: potential treatment for bacterial infections. In: BioDrugs. Band 16, Nr. 1, 2002, S. 57–62, PMID 11909002.
- ↑ Ryszard Międzybrodzki, Jan Borysowski, Beata Weber-Dąbrowska, Wojciech Fortuna, Sławomir Letkiewicz: Chapter 3 – Clinical Aspects of Phage Therapy. In: Advances in Virus Research (= Bacteriophages, Part B). Band 83. Academic Press, 1. Januar 2012, S. 73–121 (sciencedirect.com [abgerufen am 6. Februar 2017]).
- ↑ Mzia Kutateladze, Revaz Adamia: Bacteriophages as potential new therapeutics to replace or supplement antibiotics. In: Trends in Biotechnology. Band 28, Nr. 12, 1. Dezember 2010, S. 591–595, doi:10.1016/j.tibtech.2010.08.001 (sciencedirect.com [abgerufen am 6. Februar 2017]).
- ↑ L. Strój, B. Weber-Dabrowska, K. Partyka, M. Mulczyk, M. Wójcik: Successful treatment with bacteriophage in purulent cerebrospinal meningitis in a newborn. In: Neurologia i neurochirurgia polska. Band 33, Nr. 3, 1. Januar 1999, ISSN 0028-3843, PMC 10540729 (freier Volltext).
- ↑ Victor Krylov, Olga Shaburova, Elena Pleteneva, Maria Bourkaltseva, Sergey Krylov: Modular Approach to Select Bacteriophages Targeting Pseudomonas aeruginosa for Their Application to Children Suffering With Cystic Fibrosis. In: Antimicrobials, Resistance and Chemotherapy. 1. Januar 2016, S. 1631, doi:10.3389/fmicb.2016.01631, PMID 27790211, PMC 5062033 (freier Volltext).
- ↑ Alexander Sulakvelidze, Zemphira Alavidze, J. Glenn Morris: Bacteriophage Therapy. In: Antimicrobial Agents and Chemotherapy. Band 45, Nr. 3, 1. März 2001, ISSN 0066-4804, S. 649–659, doi:10.1128/AAC.45.3.649-659.2001, PMID 11181338, PMC 90351 (freier Volltext).
- ↑ G. G. Bogovazova, N. N. Voroshilova, V. M. Bondarenko: The efficacy of Klebsiella pneumoniae bacteriophage in the therapy of experimental Klebsiella infection. In: Zhurnal Mikrobiologii, Epidemiologii, I Immunobiologii. Nr. 4, ISSN 0372-9311, S. 5–8, PMID 1882608.
- ↑ niederländisches Biotech-Unternehmen Micreos bringt erstes bakterientötendes Enzym zur Behandlung von MRSA am Menschen auf den Markt. In: wallstreet-online.de. 6. November 2014 (wallstreet-online.de [abgerufen am 6. Februar 2017]).
- ↑ Scientists Engineer Viruses To Battle Bacteria. 6. März 2009.
- ↑ J. Borysowski, B. Weber-Dabrowska, A. Górski: Bacteriophage endolysins as a novel class of antibacterial agents. In: Experimental Biology and Medicine (Maywood NJ). Band 231, Nr. 4, 2006, S. 366–377, PMID 16565432.
- ↑ Benjamin K. Chan, Mark Sistrom, John E. Wertz, Kaitlyn E. Kortright, Deepak Narayan: Phage selection restores antibiotic sensitivity in MDR Pseudomonas aeruginosa. In: Scientific Reports. Band 6, 26. Mai 2016, ISSN 2045-2322, doi:10.1038/srep26717, PMID 27225966 (nature.com [abgerufen am 7. Februar 2017]).
- ↑ A virus, fished out of a lake, may have saved a man’s life. 7. Dezember 2016, abgerufen am 6. Februar 2017.
- ↑ Kevin Paul, Maya Merabishvili, Ronen Hazan, Martin Christner, Uta Herden, Daniel Gelman, Leron Khalifa, Ortal Yerushalmy, Shunit Coppenhagen-Glazer, Theresa Harbauer, Sebastian Schulz-Jürgensen, Holger Rohde, Lutz Fischer, Saima Aslam, Christine Rohde, Ran Nir-Paz, Jean-Paul Pirnay, Dominique Singer, Ania Carolina Muntau: Bacteriophage Rescue Therapy of a Vancomycin-Resistant Enterococcus faecium Infection in a One-Year-Old Child following a Third Liver Transplantation. In: Viruses. Band 13, Nr. 9, September 2021, ISSN 1999-4915, S. 1785, doi:10.3390/v13091785 (mdpi.com [abgerufen am 17. Februar 2023]).
- ↑ Rebekah M. Dedrick, Carlos A. Guerrero-Bustamante et al.: Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus. In: Nature Medicine. Band 25, S. 730–733, 8. Mai 2019, doi:10.1038/s41591-019-0437-z. Freies Autoren-Manuskript vom 8. November 2019, PMC 6557439 (freier Volltext), PMID 31068712 (ResearchGate).
- ↑ Phage Therapy Treats Patient with Drug-Resistant Bacterial Infection. Auf: hhmi.org. Howard Hughes Medical Institute. 8. Mai 2019.
- ↑ Sascha Karberg: Heilsame Bakterienfresser. Auf: tagesspiegel.de vom 9. Mai 2019.
- ↑ Daniel Bojar: Nützliche Bakterienkiller. Auf: spektrum.de – Spektrum der Wissenschaft vom Juni 2020, S. 40–45.
- ↑ Phagoburn European Research & Development (R&D) project. Abgerufen am 7. August 2017.
- ↑ Pathogen eradication by phage therapy in patients with chronic bacterial prostatitis. (Memento vom 23. Oktober 2014 im Internet Archive)
- ↑ Graham F. Hatfull: Mycobacteriophages: Pathogenesis and Applications. In: Matthew K Waldor, David I Friedman, Sankar Lal Adhya: Phages: Their role in bacterial pathogenesis and biotechnology. ASM Press, Washington DC 2005, ISBN 1-55581-307-0, S. 238–255.
- ↑ Seymour Froman, Drake W. Will, Emil Bogen: Bacteriophage active against virulent Mycobacterium tuberculosis. I. Isolation and activity. In: American Journal of Public Health and the Nation's Health. Band 44, Nr. 10, Oktober 1954, S. 1326–1333, doi:10.2105/AJPH.44.10.1326. PMID 13197609. PMC 1620761 (freier Volltext). Epub 29. August 2011.
- ↑ Universität Hohenheim: Phagen-Forschung in Deutschland: Nationales Forum Phagen. Abgerufen am 17. Februar 2023.
- ↑ BC Capital secures £500,000 funding for Biocontrol Limited to further the development of its successful phage therapy. (Memento vom 14. April 2009 im Internet Archive)
- ↑ Sourcing Development Funding: Biocontrol – Southampton Television documentary. Archiviert vom (nicht mehr online verfügbar) am 15. April 2009; abgerufen am 13. Dezember 2007.
- ↑ Scientists start germ warfare to beat illness. In: biocontrol-ltd.com. Archiviert vom (nicht mehr online verfügbar) am 13. April 2009; abgerufen am 30. April 2008.
- ↑ A. Wright, C. H. Hawkins, E. E. Änggård, D. R. Harper: A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy. In: Clinical Otolaryngology. Band 34, Nr. 4, 2009, S. 349–357. doi:10.1111/j.1749-4486.2009.01973.x.
- ↑ D. D. Rhoads, R. D. Wolcott u. a.: Bacteriophage therapy of venous leg ulcers in humans: results of a phase I safety trial. In: Journal of Wound Care. Juni 2009, Band 18, Nr. 6, S. 237–238, 240–243.
- ↑ Teenager recovers from near death in world-first GM virus treatment. Artikel in The Guardian vom 8. Mai 2019 (Link geprüft am 9. Mai 2019).
- ↑ Phage Australia. Abgerufen am 17. Februar 2023 (englisch).
- ↑ K. Thiel: Old dogma, new tricks – 21st Century phage therapy. In: Nature Biotechnology. Band 22, Nr. 1, 2004, S. 31–36, doi:10.1038/nbt0104-31, PMID 14704699.
- ↑ H. Brüssow: Phage Therapy: The Western Perspective. In: Stephen Mc Grath, Douwe van Sinderen: Bacteriophage: Genetics and Molecular Biology. Caister Academic Press, Norfolk (UK) 2007, ISBN 978-1-904455-14-1.
- ↑ G. Verbeken, D. De Vos, M. Vaneechoutte, M. Merabishvili, M. Zizi, J. P. Pirnay: European regulatory conundrum of phage therapy. In: Future Microbiology. Band 2, Nr. 5, 2007, S. 485–491, doi:10.2217/17460913.2.5.485, PMID 17927471.
- ↑ Mzia Kutateladze, Revaz Adamia: Bacteriophages as potential new therapeutics to replace or supplement antibiotics. In: Trends in Biotechnology. Band 28, Nr. 12, 2010, S. 591–595, doi:10.1016/j.tibtech.2010.08.001 (elsevier.com).
- ↑ E. C. Keen, S. L. Adhya: Phage Therapy: Current Research and Applications. In: Clinical Infectious Diseases. Band 61, Nr. 1, 1. Juli 2015, ISSN 1058-4838, S. 141–142, doi:10.1093/cid/civ257.
- ↑ Artikel auf Russisch. (PDF; 7,0 MB). Auf: files.school-collection.edu.ru; abgerufen am 9. April 2014.
- ↑ Centre de Référence des Infections Ostéo‑Articulaires complexes de Lyon. Abgerufen am 17. Februar 2023 (amerikanisches Englisch).
- ↑ Hospices Civils de Lyon: Phagothérapie (Bactériophage). Auf: chu-lyon.fr von 2017; zuletzt abgerufen am 21. März 2021.
- ↑ Wissenschaftsportal der Französischen Botschaft in Deutschland: Phagentherapie: zwei Patienten dank Viren geheilt. Auf: wissenschaft-frankreich.de vom 6. Oktober 2017; zuletzt abgerufen am 21. März 2021.
- ↑ Phagothérapie: deux patients guéris grâce à des virus. Auf: futura-sciences.com vom 21. September 2017; zuletzt abgerufen am 21. März 2021.
- ↑ Eric C. Keen, Valery V. Bliskovsky, Francisco Malagon, James D. Baker, Jeffrey S. Prince: Novel “Superspreader” Bacteriophages Promote Horizontal Gene Transfer by Transformation. In: mBio. Band 8, Nr. 1, ISSN 2150-7511, S. e02115–e02116, doi:10.1128/mBio.02115-16, PMID 28096488 (asm.org [abgerufen am 15. Februar 2017]).
- ↑ Evergreen Phage Biology and Phage Therapy (Memento vom 2. März 2007 im Internet Archive). Auf: evergreen.edu, abgerufen am 9. April 2014.
- ↑ Stuart Ira Fox: Human Physiology. 6. Auflage. McGraw-Hill, 1999, ISBN 0-697-34191-7, S. 50, 55, 448, 449.
- ↑ Vor dem Einschläfern gerettet: Phagentherapie unterstützt Nürnberger Nashorn bei der Heilung. In: MEDIZIN ASPEKTE. 8. November 2016 (medizin-aspekte.de [abgerufen am 6. Februar 2017]).
- ↑ FDA says viruses safe for treating meat. Auf: usatoday30.usatoday.com.
- ↑ A. Pirisi: Phage therapy–advantages over antibiotics? In: Lancet. Band 356, Nr. 9239, 2000, S. 1418, doi:10.1016/S0140-6736(05)74059-9, PMID 11052592.
- ↑ B. Hofer: Konservieren mit Viren. Heise, 28. Februar 2013, abgerufen am 15. Mai 2013.
- ↑ Colin Buttimer, Olivia McAuliffe, R. P. Ross, Colin Hill, Jim O’Mahony: Bacteriophages and Bacterial Plant Diseases. In: Antimicrobials, Resistance and Chemotherapy. 1. Januar 2017, S. 34, doi:10.3389/fmicb.2017.00034 (frontiersin.org [abgerufen am 7. Februar 2017]).
- ↑ Bee Killers: Using Phages Against Deadly Honeybee Diseases. Auf: youtube.com, abgerufen am 5. Juni 2016.
- ↑ Using microscopic bugs to save the bees auf der Website der Brigham Young Universität, abgerufen am 5. Juni 2016.
- ↑ E. Jończyk, M. Kłak, R. Międzybrodzki, A. Górski: The influence of external factors on bacteriophages – review. In: Folia Microbiologica. Band 56, Nr. 3, 31. Mai 2011, ISSN 0015-5632, S. 191–200, doi:10.1007/s12223-011-0039-8, PMID 21625877, PMC 3131515 (freier Volltext) – (link.springer.com [abgerufen am 10. Februar 2017]).
- ↑ J. P. Collman: Naturally Dangerous: Surprising facts about food, health, and the environment. University Press, Sausalito (CA) 2001, S. 92.
- ↑ E. Jończyk, M. Kłak, R. Międzybrodzki, A. Górski: The influence of external factors on bacteriophages – review. In: Folia Microbiologica. Band 56, Nr. 3, 31. Mai 2011, ISSN 0015-5632, S. 191–200, doi:10.1007/s12223-011-0039-8, PMID 21625877, PMC 3131515 (freier Volltext).
- ↑ Tauschgeschäft mit Erbanlagen. In: Die Zeit. 23. Februar 1962, ISSN 0044-2070 (zeit.de [abgerufen am 6. Februar 2017]).
- ↑ Amira Shousha, Nattakarn Awaiwanont, Dmitrij Sofka, Frans J. M. Smulders, Peter Paulsen: Bacteriophages Isolated from Chicken Meat and the Horizontal Transfer of Antimicrobial Resistance Genes. In: Applied and Environmental Microbiology. Band 81, Nr. 14, 15. Juli 2015, ISSN 0099-2240, S. 4600–4606, doi:10.1128/AEM.00872-15, PMID 25934615, PMC 4551174 (freier Volltext) – (asm.org [abgerufen am 6. Februar 2017]).
- ↑ Eric C. Keen, Valery V. Bliskovsky, Francisco Malagon, James D. Baker, Jeffrey S. Prince: Novel “Superspreader” Bacteriophages Promote Horizontal Gene Transfer by Transformation. In: mBio. Band 8, Nr. 1, 17. Januar 2017, ISSN 2150-7511, S. e02115–e02116, doi:10.1128/mBio.02115-16, PMID 28096488, PMC 5241400 (freier Volltext) – (asm.org [abgerufen am 6. Februar 2017]).
- ↑ Zohar Erez, Ida Steinberger-Levy, Maya Shamir, Shany Doron, Avigail Stokar-Avihail: Communication between viruses guides lysis–lysogeny decisions. In: Nature. Band 541, Nr. 7638, S. 488–493, doi:10.1038/nature21049.
- ↑ Thomas Häusler: The advantages and disadvantages of phage therapy. In: Binturong. Abgerufen am 17. Mai 2019 (englisch).