Phosphofructokinase-2 oder Fructose-2,6-bisphosphatase (auch PFKFB, PFK-2/FBPase-2) steht für Proteine, die eine doppelte Enzymfunktion besitzen, und von denen es im Menschen vier Isoformen gibt, mit den entsprechenden Genen PFKFB1, PFKFB2, PFKFB3 und PFKFB4. Je nachdem, ob das Protein phosphoryliert wurde, katalysiert es die Synthese (EC 2.7.1.105) oder die Hydrolyse (EC 3.1.3.46) von Fructose-2,6-bisphosphat, das seinerseits die Glycolyse aktiviert und die Gluconeogenese inhibiert. Es handelt sich also um einen molekularen Schalter. PFKFB1 wird hauptsächlich in der Leber gebildet, tritt aber auch in Skelettmuskelzellen auf.[1] Die 1980 entdeckte[2] PFKFB2 hingegen findet sich in Herzmuskelzellen, wobei es dort bei Phosphorylierung des bifunktionellen Enzyms zu einer verstärkten Kinaseaktivität kommt. Dadurch ist bei Adrenalinausschüttung und damit verbundener erhöhten PKA-Aktivität trotzdem eine verstärkte Glykolyse möglich. PFKFB3 hat zwar keine bevorzugte Lokalisierung, wird jedoch in Tumoren verstärkt produziert. PFKFB4 wurde in den Hoden gefunden.[3][4]
| Phosphofructokinase-2/ Fructose-2,6-bisphosphatase | ||
|---|---|---|
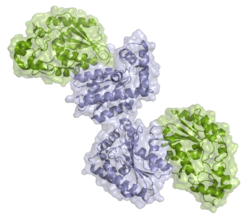
| ||
| Bänder-/Oberflächenmodell des Dimer. Die PFK-Domäne ist blau, die FB-Domäne grün eingefärbt, nach PDB 1K6M | ||
| Masse/Länge Primärstruktur | 468–520 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Name(n) | PFKFB1, PFKFB2, PFKFB3, PFKFB4 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten | |
Katalysierte Reaktionen Bearbeiten
Die eine Enzymfunktion ist die Katalyse der Phosphorylierung von Fructose-6-phosphat zu Fructose-2,6-bisphosphat, einem wichtigen Regulator der Glykolyse und Gluconeogenese. Diese Reaktion führt die dephosphorylierte Form des Enzyms (Phosphofructokinase-2) aus. Sie darf nicht mit der Bildung von Fructose-1,6-bisphosphat durch die Phosphofructokinase 1 verwechselt werden, einem zentralen Schritt der Glykolyse.
Die andere Funktion ist die Katalyse der Abspaltung eines Phosphat-Ions von Fructose-2,6-bisphosphat. Dies wird durch die phosphorylierte Form des Enzyms (Fructose-2,6-bisphosphatase) ausgeführt.
Es handelt sich bei den beiden katalysierten Reaktionen nicht um gegenseitige Umkehrreaktionen, da bei der ersten ATP verbraucht wird, während bei der zweiten Phosphat frei entsteht. Auch befinden sich die beiden katalytischen Zentren an unterschiedlichen Positionen im Molekül. Bei der Phosphofructokinase handelt es sich um ein Tandem-Enzym (= Katalysiert in phosphorylierter und dephosphorylierter Form).
Literatur Bearbeiten
- V. E. van Schaftingen, H. G. Hers: Phosphofructokinase 2: The enzyme that forms fructose 2,6-biphosphate from fructose-6-phosphate and ATP. In: Biochem Biophys Res Comm. Band 101, 1981, S. 1078–1084.
Weblinks Bearbeiten
- Reactome: PFKFB
Einzelnachweise Bearbeiten
- ↑ Oleksandr Minchenko, Iryna Opentanova, Jaime Caro: Hypoxic regulation of the 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase gene family (PFKFB-1–4) expression in vivo. In: FEBS Letters. Band 554, Nr. 3, 2003, ISSN 1873-3468, S. 264–270, doi:10.1016/S0014-5793(03)01179-7 (wiley.com [abgerufen am 13. Juli 2021]).
- ↑ H. G. Hers, E. van Schaftingen: Fructuose 2,6-biphosphate 2 years after its discovery. In: Biochem J. Band 206, 1982, S. 1–12.
- ↑ H. Bando et al.: Phosphorylation of the 6-phosphofructo-2-kinase/fructose 2,6-bisphosphatase/PFKFB3 family of glycolytic regulators in human cancer. Clin Cancer Res. 11/16/2005:5784–5792, PMID 16115917.
- ↑ M. H. Rider et al.: 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: head-to-head with a bifunctional enzyme that controls glycolysis. Biochem J. 381/Pt 3/2004:561–579. PMID 151760386.