Hydroxylamin
Hydroxylamin ist eine farblose, kristalline anorganische chemische Verbindung. Die Verbindung ist thermisch instabil und wird deshalb nur in wässriger Lösung vertrieben und verwendet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
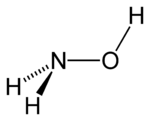
| |||||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hydroxylamin | ||||||||||||||||||
| Andere Namen |
Oxyammoniak | ||||||||||||||||||
| Summenformel | NH2OH (Hydroxylamin)[1] | ||||||||||||||||||
| Kurzbeschreibung |
hygroskopische, geruch- und farblose Plättchen oder Nadeln[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 33,03 g·mol−1 (Hydroxylamin) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
58 °C (29 mbar)[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte Bearbeiten
Das Hydroxylamin wurde im Jahr 1865 vom deutschen Chemiker Wilhelm Lossen entdeckt.[9] Die Reindarstellung gelang 1891 dem niederländischen Chemiker Cornelis Adriaan Lobry van Troostenburg de Bruyn.[10][11]
Synthese Bearbeiten
Hydroxylamin lässt sich durch Reduktion höherer Oxidationsstufen des Stickstoffs (NO, NO2−, NO3−) mit Wasserstoff, Schwefliger Säure oder elektrischem Strom herstellen. Technisch wird es durch Einleiten eines Gemisches aus Stickstoffmonoxid und Wasserstoff in eine schwefelsaure Suspension eines Katalysators (Palladium oder Platin) auf Aktivkohle hergestellt,[12] die Ausbeute beträgt dabei 90 %.
Eine andere technische Methode ist das Einleiten von Schwefeldioxid in eine Lösung von Ammoniumnitrit in Schwefelsäure bei 0 bis 5 °C. Hierbei entsteht erst Diammoniumhydroxylaminbis(sulfonat) N(SO3NH4)2OH, das sich bei 100 °C durch Wasser langsam in Hydroxylamin und Hydrogensulfat spaltet. Auch bei dieser Methode beträgt die Ausbeute etwa 90 %.
Eine weitere technische Methode ist die elektrochemische Reduktion von Salpetersäure in 50%iger Schwefelsäure.
Reaktionsverhalten Bearbeiten
Unter Luftausschluss ist Hydroxylamin einige Wochen haltbar. In wässriger Lösung ist es unter Luftausschluss ziemlich stabil. Bei Anwesenheit von Luftsauerstoff zersetzt sich Hydroxylamin sowohl als Reinstoff als auch in Lösung sehr schnell, oberhalb von 70 °C erfolgt die Zersetzung explosionsartig.[3] Doch selbst konzentrierte Lösungen können heftig explodieren, wie Unglücksfälle in Japan und den USA gezeigt haben.[13][14]
Wegen seiner Instabilität wird Hydroxylamin meist in seine Salze (beispielsweise Hydroxylaminhydrochlorid, Hydroxylammoniumsulfat) umgewandelt.
Die vergleichsweise hohen Schmelz- und Siedetemperaturen von Hydroxylamin lassen sich zum einen durch H-Brückenbildung, andererseits durch die teilweise Tautomerisierung zum Aminoxid, das ionische Ladungen trägt, erklären. Außerdem wirkt Hydroxylamin leicht als Ampholyt.
Mutagene Wirkung Bearbeiten
Hydroxylamin wandelt Cytosin durch Hydrolyse zu Uracil um. Uracil paart aber im Gegensatz zu Cytosin mit Adenin, sodass sich das Basenpaar C-G nach zwei Replikationen zu T-A umwandelt. Da Uracil jedoch in der DNA nicht vorkommt, werden solche Fehler leicht erkannt und korrigiert.
Verwendung Bearbeiten
Der größte Teil des industriell hergestellten Hydroxylamins wird mit Aldehyden oder Ketonen zu Oximen umgesetzt. 97 % der Weltjahresproduktion von Hydroxylamin wird zur Gewinnung von Cyclohexanonoxim aus Cyclohexanon verwendet, das über Caprolactam in Polyamid 6 umgewandelt wird (siehe Beckmann-Umlagerung). Außerdem findet es auch Verwendung in der Neber-Umlagerung.
Weblinks Bearbeiten
Einzelnachweise Bearbeiten
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 464.
- ↑ a b c Eintrag zu Hydroxylamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Mai 2014.
- ↑ a b c d e f g Eintrag zu Hydroxylamin, wässrige Lösung in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ a b c d e David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-66.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 837, ISBN 978-0-911910-00-1.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ Eintrag zu Hydroxylamine hydrochloride bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ Eintrag zu Hydroxylamine (> 55 % in aqueous solution) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. September 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ W. Lossen J. prakt Chem. 96 (1865) 462.
- ↑ C. A. Lobry de Bruyn: Sur l'hydroxylamine libre in Recueil des travaux chimiques des Pays-Bas 10 (1891) 100-112.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 36 pdf.
- ↑ M. Binnewies et alii: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6. S. 484.
- ↑ Hiroshi Koseki, Mitsuo Kobayashi, Masamitsu Tamura: Explosion and Fire of Hydroxylamine – Ojima Town, Gunma, Japan. In: Failure Knowledge Database – 100 Selected Cases. Association for the Study of Failure, abgerufen am 20. April 2021 (englisch).
- ↑ Explosion bei Allentown, Pennsylvania, USA.



